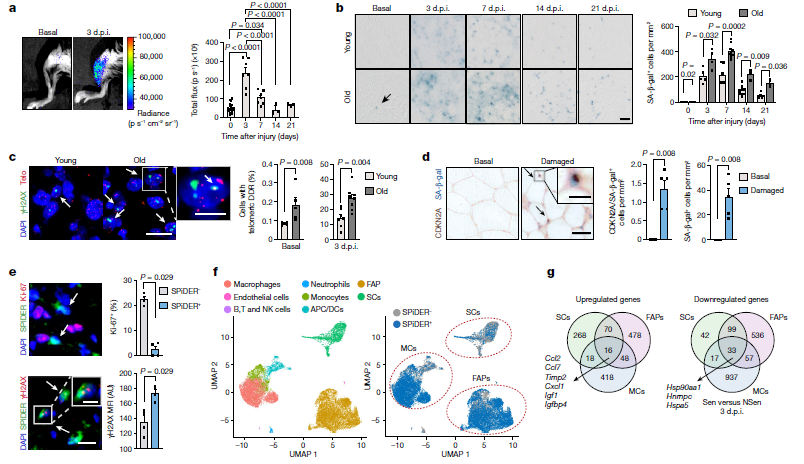
图1 年轻和年老小鼠肌肉再生中的衰老细胞
为了研究骨骼肌中的细胞衰老,研究人员使用p16-3MR小鼠,分析了衰老相关β-半乳糖苷酶(SA-β-gal)活性作为衰老细胞的标志物,衰老细胞在老年小鼠损伤肌肉中更丰富,持续时间更长。此外,老年再生肌肉的端粒dna损伤反应 (γH2AX端粒免疫染色)也高于年轻小鼠或未损伤肌肉。为了确定体内衰老细胞的性质,研究人员建立了基于荧光探针SPiDER-β-gal的荧光激活细胞分选(Fluorescence-activated cell sorting, FACS)方法,从肌肉组织中分离出荧光衰老细胞。他们观察到,损伤后老化组织中的衰老细胞比年轻组织中的衰老细胞多得多。
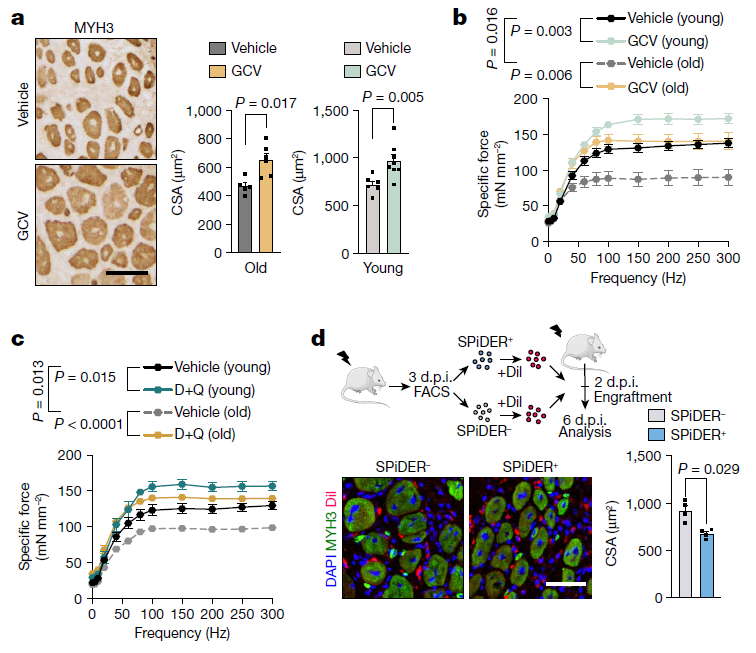
图2 细胞衰老阻碍了肌肉的再生
为了确定衰老细胞在肌肉再生中的作用,研究人员每天用更昔洛韦(Ganciclovir, GCV)治疗年轻和老年p16-3MR小鼠。GCV减少了受损肌肉中衰老细胞的存在,GCV治疗挽救了老年小鼠有缺陷的肌肉再生,减少了炎症和纤维化,增强了力量生成,并加速了年轻p16-3MR小鼠的再生过程。每天用人参皂苷化合物达沙替尼和槲皮素治疗时,减少了两个年龄段的SA-β-gal+细胞数量,加速了再生,增加了力,并减少了基质沉积和炎症。证明衰老细胞对年轻和年老小鼠的肌肉再生都是有害的。
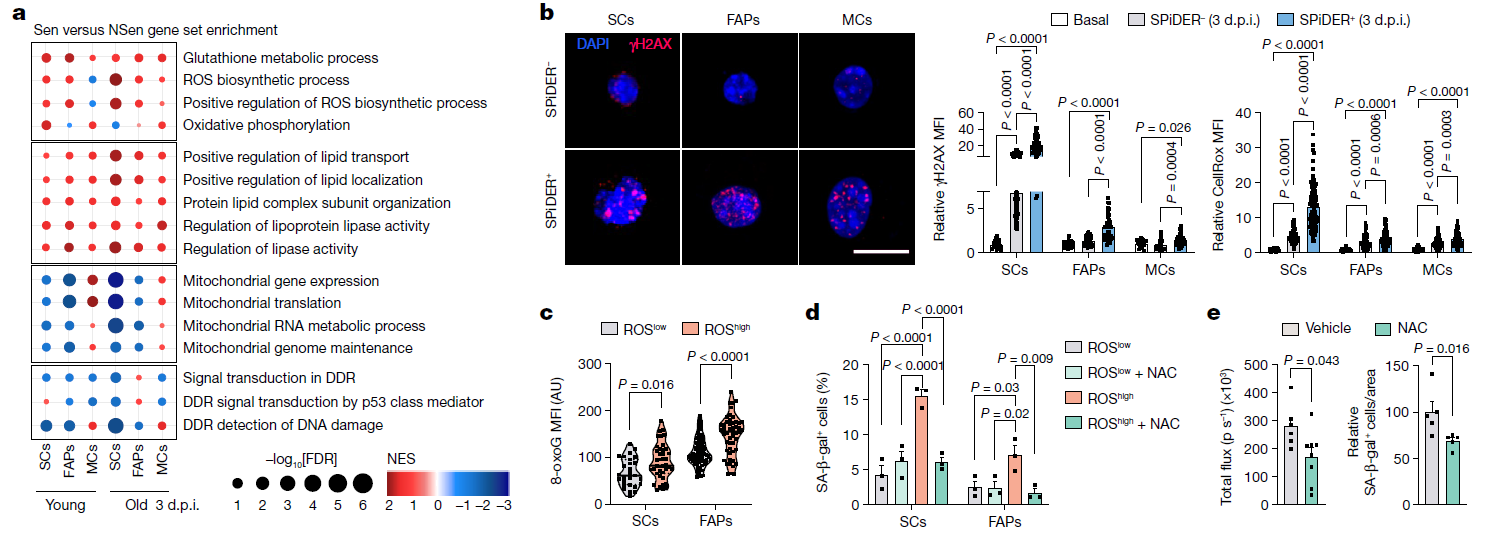
图3组织损伤和衰老是氧化应激和DNA损伤导致衰老的主要生态位细胞
为了排除衰老细胞所观察到的作用取决于组织损伤的程度,研究人员用局部肌肉微针刺诱导短暂的轻度损伤及mdx小鼠(Duchenne肌营养不良模型)的慢性严重损伤肌肉。他们认为,无论年龄大小,肌肉生态位中衰老细胞的突然(轻度损伤)或持续(慢性损伤)对再生都是有害的。这些发现挑战了普遍的观点,即衰老细胞在急性损伤后短暂存在时是有益的,尤其是在年轻组织中。
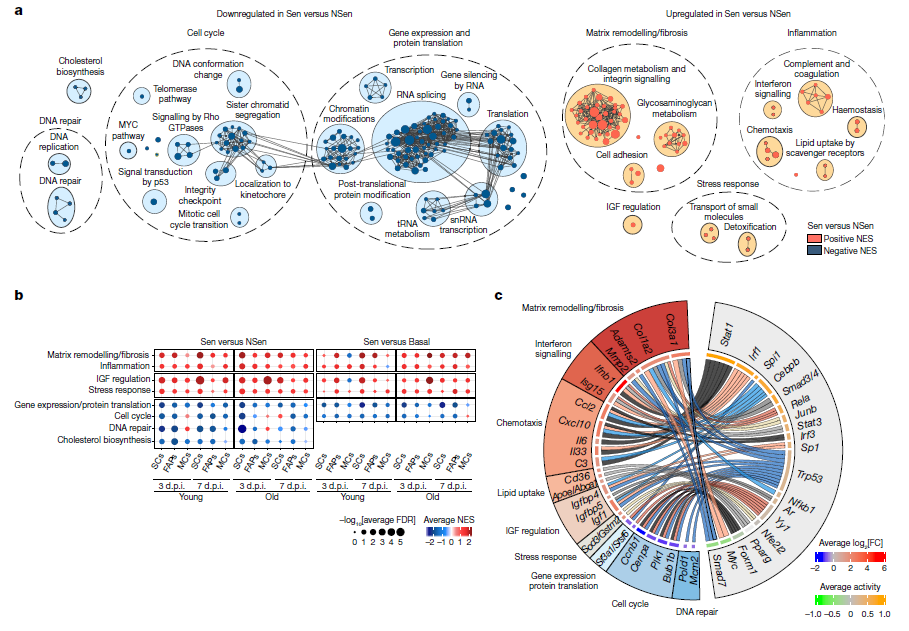
图4 两个主要的共同特征定义了衰老细胞的细胞类型、再生阶段和寿命
为了更深入地表征来自再生肌肉的衰老细胞的三个主要群体,研究人员建立了基于SCs、FAPs和MCs的细胞表面标记物与SPiDER试剂偶联的FACS方法。该方法同时分离了三种细胞类型的SPiDER+和SPiDER−亚群(以下称为衰老(Sen)和非衰老(NSen)细胞),并通过免疫染色和基因表达进行了验证和单细胞水平。研究人员确认MC,FAP和SC(按丰度顺序)是再生肌肉中的主要衰老细胞类型。尽管衰老细胞内的基因表达存在差异,但研究人员揭示了两个主要的保守通用特征定义了衰老细胞:炎症和纤维化。研究人员还确定,根据它们的起源谱系,衰老细胞具有在整个生命中保留的独特特征,表明它们在保持身份特征的同时共享通用程序,并适应其起源和年龄的特性。因此,研究人员的研究为体内衰老提供了更好的定义:尽管是一种不可逆转的停滞状态,但衰老包括分子多样性和活力(对时间和损伤方式敏感)的特征以及保守的特征。
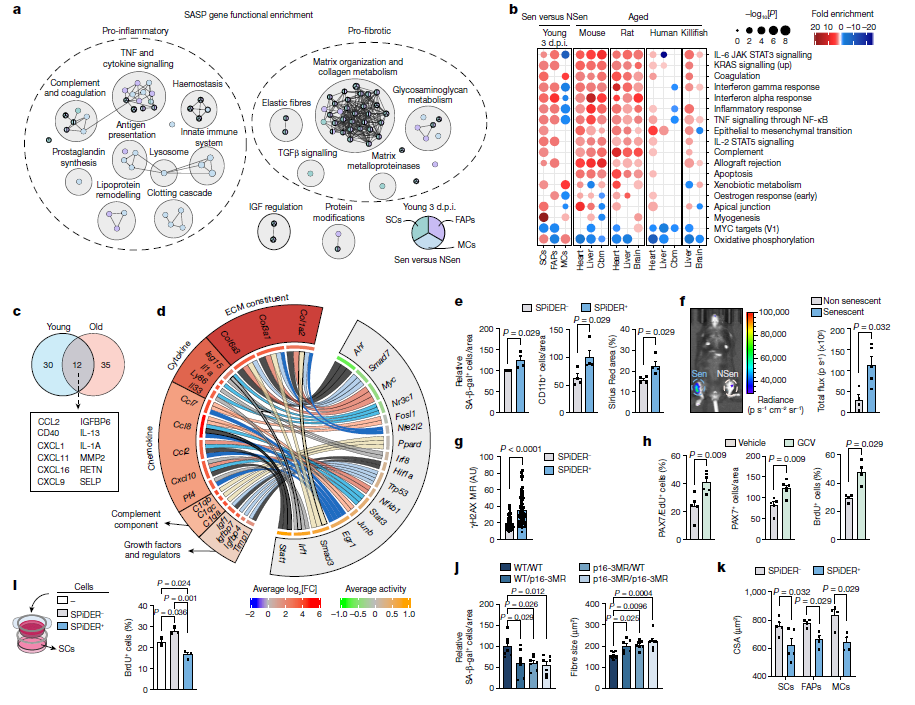
图5 衰老细胞通过促炎和促纤维化因子分泌,在年轻的再生生态位中创造一个类似衰老的微环境
为了评估SASP如何影响肌肉再生,研究人员重建了Sen细胞和NSen SCs之间的配体-受体相互作用,揭示了主要的炎症相互作用。参与这些相互作用的转录因子的信号通路影响分析显示,所有Sen细胞产生的SASP激活了接受NSen-SC的下游信号通路(衰老、凋亡和炎症反应),并抑制了细胞周期和增殖通路。因此,SASP成分可能会引起NSen SCs的增殖停滞或旁分泌衰老。通过将体外诱导的衰老(与非衰老)WT细胞移植到p16-3MR小鼠的损伤前肌肉中,证实了这种旁分泌衰老诱导。值得注意的是,将分选的SPiDER+和SPiDER-移植到未受伤的肌肉中足以诱导内源性SCs中的DNA损伤。相比之下,GCV处理的p16-3MR小鼠在再生肌肉生态位内显示出更高数量的增殖和总SCs。因此,衰老细胞通过抑制SC增殖的旁分泌促炎和促纤维化SASP功能抑制肌肉再生。
总之,研究表明衰老细胞是整个生命中组织再生的决定性因素。SCs亚群和生态位细胞转化为永久停滞的衰老细胞不仅减少了再生的细胞,而且通过促炎性SASP,给予年轻组织一个衰老样的炎症生态环境。从机理上讲,SASP诱导周围健康细胞衰老,从而进一步传播衰老并降低干细胞增殖。与此相一致,衰老细胞数量的减少改善了炎症和纤维化SASP的再生。最后,研究人员鉴定了CD36作为体内多形性细胞受体。总之,这些结果与传统的观点有所冲突。值得注意的是,在组织再生环境之外,衰老细胞在肌肉中的积极和消极作用已被提出,例如在运动肌肉中,即在不同的体内环境中衰老细胞功能存在复杂性。
参考文献
1.Fuchs, E. & Blau, H. M. Tissue stem cells: architects of their niches. Cell Stem Cell 27, 532-556 (2020).
2. Sousa-Victor, P., Garcia-Prat, L. & Munoz-Canoves, P. Control of satellite cell function in muscle regeneration and its disruption in ageing. Nat. Rev. Mol. Cell Biol. 23, 204-226 (2022).
3. Franceschi, C. & Campisi, J. Chronic inflammation (inflammaging) and its potential contribution to age-associated diseases. J. Gerontol. A 69, S4-S9 (2014).
4. Basisty, N. et al. A proteomic atlas of senescence-associated secretomes for aging biomarker development. PLoS Biol. 18, e3000599 (2020).
5. Zhu, Y. et al. The Achilles heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell 14, 644-658 (2015).
6. Demaria, M. et al. An essential role for senescent cells in optimal wound healing through secretion of PDGF-AA. Dev. Cell 31, 722-733 (2014).
7. Roy, A. L. et al. A blueprint for characterizing senescence. Cell 183, 1143-1146 (2020).