一种依赖肠道微生物群的肠道-大脑通路可以调节运动表现
点评理由:该研究首次揭示肠道微生物组对参与运动表现的脑回路的影响,从多角度验证了肠道菌群及其代谢物通过调节神经元并最终影响运动水平的机制,内容涵盖面广,结论具有说服力。
运动锻炼是公认的最重要、最容易为健康带来获益的生活方式,有助于预防多种疾病。然而,调节个体参与体育活动动机的机制保持不完全理解。无论是竞技运动还是休闲运动,都需要一个重要的刺激因素,那就是从长时间的体育活动中获得的激励快感,这种快感是由大脑中运动引起的神经化学变化引发的。按照这个思路,科学家寻找决定运动表现的因素,为提高运动水平和改善公众健康提供有效方法。
近日,由宾夕法尼亚大学佩雷尔曼医学院的Lenka Dohnalová和Christoph A. Thaiss教授领衔的研究团队在《Nature 》期刊发表了重要的研究成果。他们从遗传和元基因组、机器学习和代谢物组学分析的角度,在老鼠身上发现了一种肠道-大脑连接,通过在体育活动中增加多巴胺信号来提高运动表现(图1),揭示了肠道细菌提高运动能力的机制。该研究扩展了我们对肠道和纹状体之间神经通路的了解,也为研究该通路在其他运动生理当中的调节作用提供了坚实基础。

图1. 研究成果展示图
本研究为动物实验研究,采用199只多样性远交系(Diversity outbred, DO)小鼠的队列,让小鼠在滚轮和跑步机上进行耐力跑步,收集小鼠的运动时间,距离和速度评估运动能力;采集血液、粪便的样本进行基因序列逆袭、肠道菌群种类的分析和代谢物分析。
首先对小鼠进行了基因分型,构建遗传亲缘矩阵。随后,小鼠在跑步机上进行耐力跑步(图2)。结果发现遗传对运动能力个体间变异的贡献很小,但是血清代谢组、肠道微生物组组成和代谢参数在整个动物队列中差异很大。接下来,研究人员让小鼠服用抗生素清除肠道细菌。结果发现用广谱抗生素消除微生物群会降低小鼠的运动性能;而将DO小鼠的微生物组样本转移到无菌小鼠后显示供体和受体的之间运动性能存在很强的相关性。这些结果表明微生物组对DO小鼠的运动能力有很强的贡献。
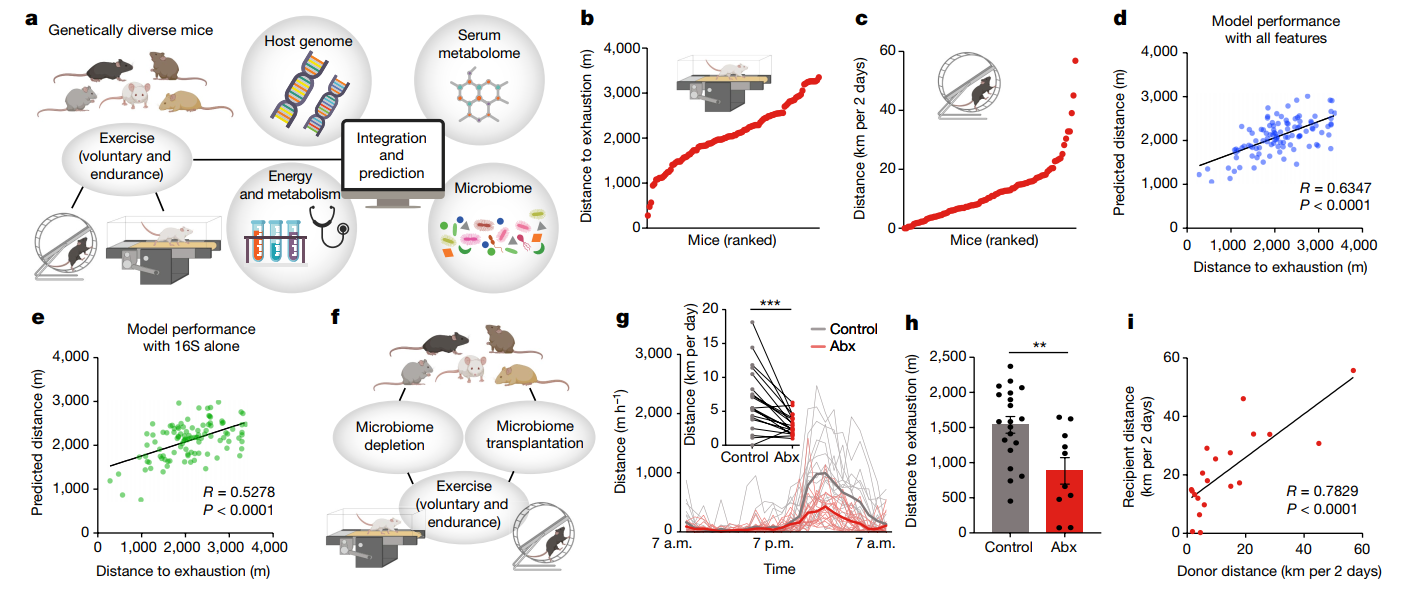
图2. 小鼠的运动水平与肠道菌群及代谢物水平有关联
随后,研究者尝试确定微生物群落影响运动表现的机制。对抗生素治疗小鼠的纹状体在跑步机运动前后进行单核RNA测序,确定了表达多巴胺受体D1和D2的中棘神经元的主要群体。结果显示Arc和Fos等早期基因的表达因运动而显著升高,在没有微生物组的情况下,这种升高被抑制了。这些数据表明,肠道微生物定植对于运动引发的纹状体激活非常重要。
考虑到纹状体中棘神经元是由多巴受体控制的 [1],研究者接下来的实验测量了小鼠的纹状体多巴胺水平。通过使用荧光多巴胺传感器实时测量多巴胺水平,结果显示在不同的运动持续时间后,小鼠大脑腹侧和背侧纹状体中的多巴胺快速持续上调(图3)。引人注目的是,这种多巴胺反应在抗生素治疗的动物中几乎被消除,进一步强调了微生物组对纹状体多巴胺反应的重要性。
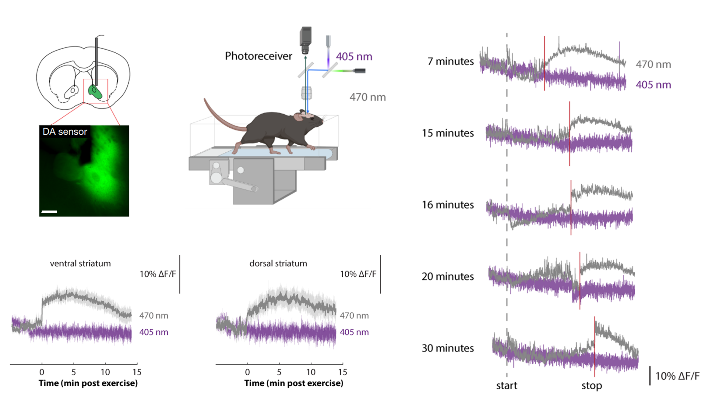
图3. 小鼠的运动水平与多巴胺水平的关联
下一步,研究人员开始探寻肠道微生物定植如何影响中脑多巴胺水平。他们最终专注于肠道神经传入感觉神经元。对表达Trpv1的神经元进行化学沉默后,观察到了运动性能的降低;而低剂量Trpv1激动剂辣椒素激活TRPV1+传入神经元后,可恢复小鼠的运动能力。这些发现表明,微生物组对纹状体中多巴胺水平和运动表现的影响需要TRPV1+神经元。
为了确定究竟是脊髓或是迷走神经传入作为了微生物组影响运动的主要介质,研究人员检查了小鼠的背根神经节(Dorsal Root Ganglia, DRG)和节状神经节(Nodose Ganglia, NG)在运动中的情况。结果显示抗生素治疗减少了运动诱导的DRG的神经元激活,但没有减少NG) (图4),这表明脊髓通路对微生物来源的信号更敏感。
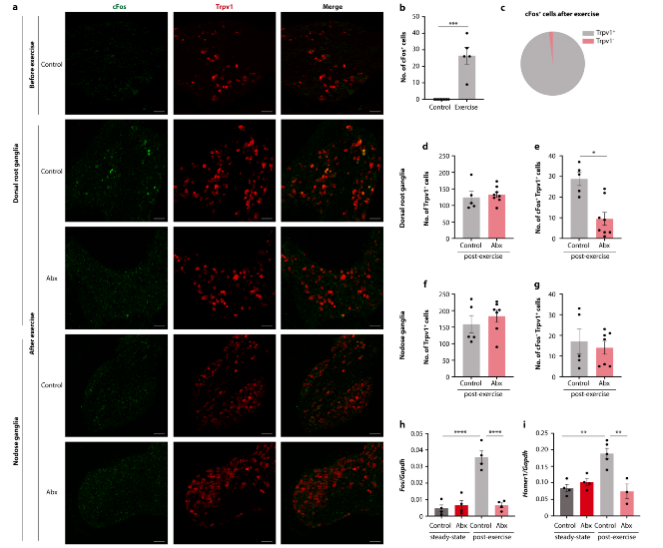
图4. 抗生素治疗降低了DRG的激活而没有减少NG的激活
接下来研究人员确定了刺激DRG神经元的特定微生物组成分。首先将DRG神经元暴露于使用不同抗生素的小鼠的粪便提取物中,观察到钙信号与动物的运动表现密切相关。然后他们进行了非靶向代谢组学研究,其中最有效的代谢物是多脂肪酸酰胺(Fatty Acid Amides, FAAs),如n -油乙醇酰胺(N-Oleoylethanolamide , OEA) (图5)。这一结果表明FAA代谢物如OEA可能刺激感觉神经元以促进身体活动。
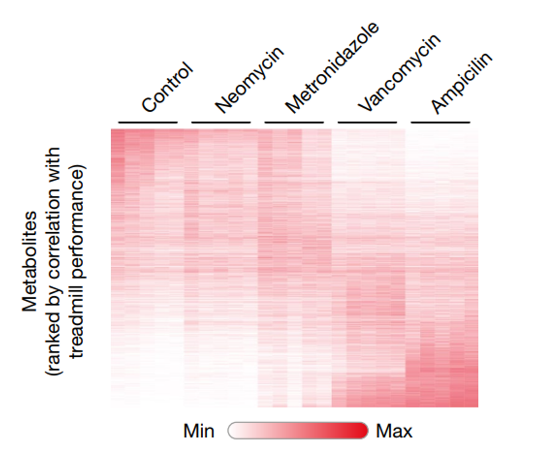
图5.非靶向代谢组学热图分析最有效的代谢物
随后,研究者调查了微生物组产生的FAA是否可以解释其性能刺激效应。最近发现的两种肠道菌群,即Eubacterium和Coprococcus,含有负责FAA生物合成的生物合成基因簇[2]。他们生成了含有该基因簇必需基因的大肠杆菌菌株,并将含有FAA生物合成基因簇或空载体的大肠杆菌菌株定植在无菌小鼠中。结果显示该基因簇赋予大肠杆菌在体内产生类似OEA的FAAs的能力,并刺激DRG神经元中的钙信号。并且,产生FAA的菌株增强了在小鼠的跑步运动(图6)。这些发现强调,使代谢产物家族产生的微生物基因集群可以影响宿主的运动能力。
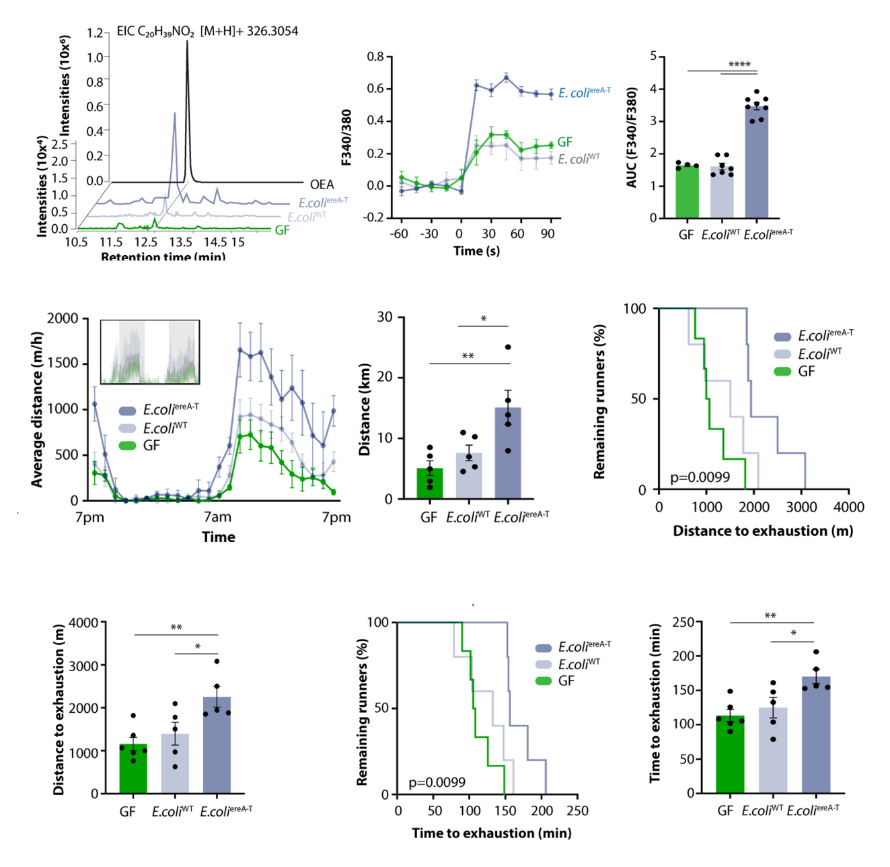
图6. 暴露于小鼠和单定植e . coliereA−T或e . coliWT的小鼠粪便提取物中的DRG神经元钙成像的平均定量记录
最后,研究者探讨了肠道FAAs刺激感觉神经元的机制及其对运动动机的影响。FAA代谢物是内源性大麻素受体CB1的激动剂,而CB1由TRPV1+ DRG神经元表达,因此研究者推测FAAs刺激CB1可能是驱动了感觉神经元活动、纹状体多巴胺释放和运动表现。他们的结果验证了这一假设,在CB1缺陷小鼠在运动反应中表现出DRG神经元活性降低,纹状体多巴胺减少,运动能力受损,而CB1受体激动剂CP55,940增强性能。此外,研究者使用外周限制性CB1抑制剂AM6545,它产生了同样的CB1缺陷条件下运动能力的下降。另一方面,AM6545治疗提高了纹状体区域单胺氧化酶(monoamine oxidase, MAO)的表达,并减弱了运动诱导的多巴胺激增,表明外周CB1信号对运动的影响是由多巴胺所介导的。
该研究的优势是明显的,它首次揭示了“跑步者高潮”背后的神经化学效应可能受到胃肠道的影响,从进化上讲,肠道代谢产物对运动诱导的奖赏和激励回路的调节可能有助于将营养物质的可用性和肠道微生物定植状态与长期从事体力活动的准备和能力相结合。但该研究存在一定局限性,目前该研究仅在动物小鼠中开展,尚缺少更广泛的体内实验进行验证。
总之,通过本研究我们明确了,肠道微生物组有助于肠道FAA代谢产物的产生,这些代谢产物触发CB1表达TRPV1+感觉神经元,进而向大脑发送运动诱导的传入信号,并促进纹状体MAO表达的下调。MAO的这种下调有助于提高多巴胺水平和增强运动能力。
参考文献
1. Friend DM, Devarakonda K, O'Neal TJ, Skirzewski M, Papazoglou I, Kaplan AR, Liow JS, Guo J, Rane SG, Rubinstein M, Alvarez VA, Hall KD, Kravitz AV. Basal Ganglia Dysfunction Contributes to Physical Inactivity in Obesity. Cell Metab. 2017;25(2):312-321.
2. Chang FY, Siuti P, Laurent S, Williams T, Glassey E, Sailer AW, Gordon DB, Hemmerle H, Voigt CA. Gut-inhabiting Clostridia build human GPCR ligands by conjugating neurotransmitters with diet- and human-derived fatty acids. Nat Microbiol. 2021;6(6):792-805.