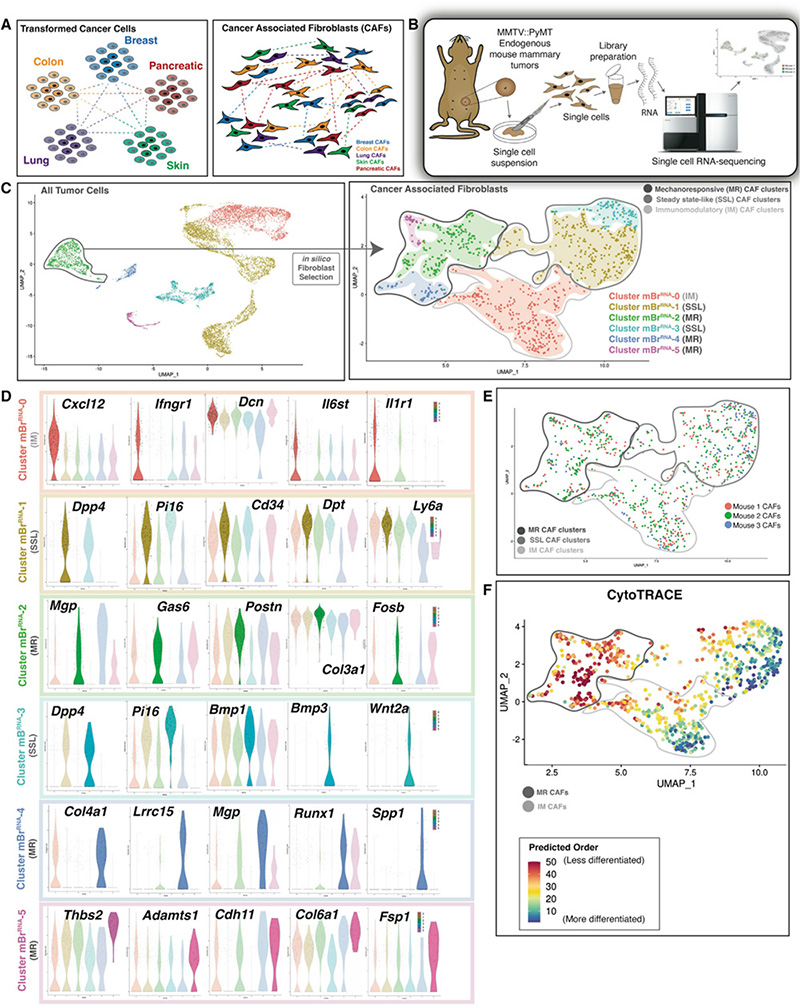
为进一步明确实体瘤中CAF活化过程中表观基因组的变化规律,作者又使用单细胞ATAC-seq对染色质可及性进行了测定,并与单细胞转录组结果进行了联合分析。在ArchR平台中使用基于Louvain算法对数据进行分析,可得到4个异质性较高的基于染色质可及性不同的CAFs亚群(图2A)。对单细胞转录组和表观组的联合分析显示,最初的六个scRNA-seq 所得CAF亚群中四个强烈映射scATAC分析所得的细胞亚群(图2B)。细胞较少的簇(mBrRNA-3 和 mBrRNA-5)没有清楚地映射到scATAC-seq数据,这可能是由于与其他亚群相比,在基因表达水平上存在较少的转录因子。mBr ATAC -1 的表观基因组显示,SSL特征基因的染色质可及性高,包括Dpp4、Ly6a和Cd34(图2C和2D)。mBr ATAC -0 同样显示IM特征基因的染色质可及性改变最为明显,如Cxcl12、Il6和Ccl19(图2C-2E)。在MR CAF亚群中,mBr ATAC -4 显示接近Gas6、Yap 和Acta2的可及性显著升高,提示其支持肌成纤维细胞表型(图2C-2E)。
为在肿瘤发展过程中进一步关联CAF中的基因表达和染色质可及性变化,作者使用Chromium Single Cell Multiome 平台对小鼠乳腺不同的病理生理情况进行了同步测量,具体包括:非肿瘤小鼠乳腺实质、早期乳腺肿瘤和晚期乳腺肿瘤(图2F)。细胞聚类显示有六种转录和表观基因组不同的细胞类型(图2G,左图)。对成纤维细胞进行进一步细分可得到八个CAFs簇(图2G,右图)。mBr Multi -2 中的细胞表现出与干细胞样Pi16特征惊人的相似,与其在稳态、非恶性乳腺组织中的存在一致(图2G-2H)。然后,作者使用anchor-based label transfer方法将最初的小鼠乳腺 scRNA-seq (mBr RNA ) 簇与 mBr Multi time course 进行了比较。结果显示,SSL簇(mBr RNA -1 和 mBr RNA -3)与来自稳态非恶性组织的细胞相关(图2G)。使用 chromVAR 分析转录因子结合位点的染色质可及性,显示IM CAFs中促炎性转录因子(如Stat2)高度可及(图2I)。在MR成纤维细胞可观察到纤维化相关TF的可及性,如TGFB相关基因Smad2::Smad3(图2I)。在IM和MR CAFs簇中都发现了Runx1基序的可及性,这表明相较于SSL CAFs,另两种CAFs分化程度可能更高。总的来说,作者在这里使用单细胞多组学及联合分析的方法,进一步明确了CAFs的三个异质性亚群的存在,并初步明确了其分子特征。
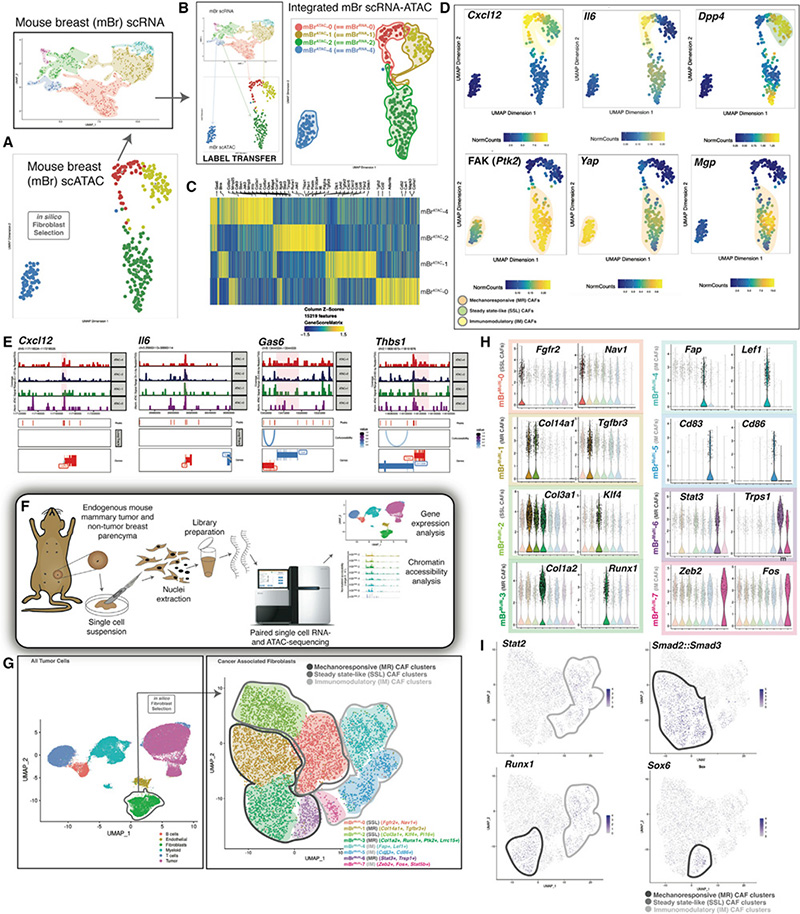
为了进一步探索CAFs异质性在实体瘤生物学中的重要性,作者使用空间转录组的手段对mBr小鼠样本进行来检测(图3A)。同时,结合scRNA-seq的结果,对CAF和其他非成纤维细胞的表达进行了分析(图3B)。且为了保证结果的一致性,空间转录组的样本与其他转录组样本均用同样时间点的样本进行联合分析(图3C)。结合多组学的结果,系统分析预测每个成纤维细胞与非成纤维细胞类型的在TME空间上的贡献(图3D-3F)。应用最近邻分析方法分析显示,单细胞转录组预测的SSL、MR和IM成纤维细胞的空间分布在很大程度上与空间单细胞检测观察到的一致(图3G)。为在组织水平上进一步探索乳腺CAFs亚群的谱系,作者使用了Rainbow小鼠模型(一种多色谱系追踪模型用于阐明细胞激活和增殖),通过将CODEX空间蛋白质组学分析纳入Rainbow小鼠模型来评估表达αSMA肌纤维母细胞群体的可塑性(图3H)LRRC15 和PDPN强烈共定位在右上角(图3H-3J)。另一方面,CD26和Ly6C位于的右下角,可能是代表SSL和IM CAF(图3H-3J)。SSL和IM成纤维细胞表现出与αSMA谱系诱导的 mCerulean、mCherry和mOrange群体相关的彩虹荧光,证实了αSMA阳性成纤维细胞之间的谱系可塑性。总的来说,通过Rainbow谱系示踪手段,作者发现MR CAF可能存在分化为SSL或IM CAF的潜力。
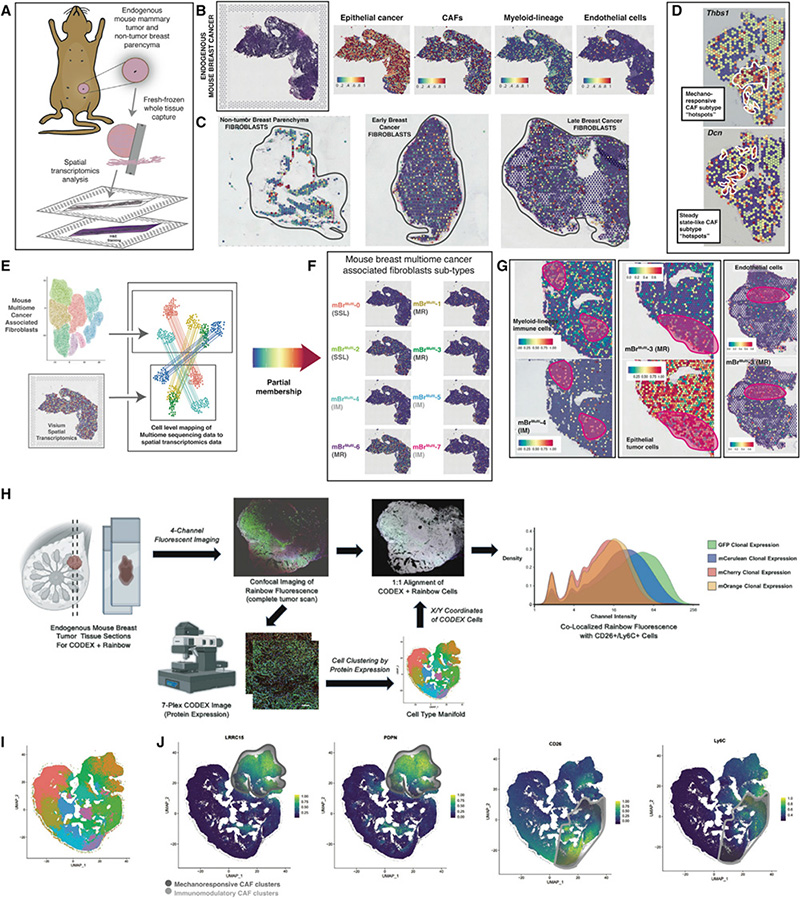
为明确CAFs在小鼠和人类之间进化保守的程度,作者收集了3例乳腺癌患者的样本,进行了单细胞测序分析(图4A)。病人样本中共鉴定出约5种主要细胞,随后作者对成纤维细胞进行进一步分析(图4B)。结果显示,人CAFs也可分为6个亚群,hBr RNA -0至5(图4C),与mBr RNA -2 相似,hBr RNA -3 CAF表现出与机械转导和纤维化相关的基因表达显着升高(图4D),表明其为MR亚群。相比之下,hBr RNA -0细胞的特征是SSL相关基因的表达升高;hBr RNA -4和hBr RNA -5 CAF细胞因子表达与IM亚群的特征一致(图4D)。尽管三名患者的年龄、肿瘤类型和分期不同,但肿瘤CAFs的分布没有显著差异(图4E)。同时,作者对人和小鼠的CAF亚群进行了跨物种综合分析(图4F),结果显示hBr RNA和mBr RNA CAF亚群之间存在强烈的相似性。为明确这一在乳腺癌中鉴定得到的CAF的异质性是否在其他上皮瘤中保守的存在,作者对胰腺癌的患者的样本进行单细胞测序(图4G),而后测序结果中CAFs进行进一步的分析可得到7个具有显著特征的CAFs亚群(图4H-L),对乳腺癌的单细胞转录组测序和胰腺癌的单细胞转录组测序结果进行联合分析,有五个CAF亚细胞簇可能是共有的,同时有一个细胞簇可能为胰腺特有的(hBrRNA-hPaRNA-3,图4M-O);同时,使用跨物种综合分析显示,MR mBr RNA -2、mBr RNA -4、mBr RNA -5 和MR hBr RNA -hPa RNA -0、hBr RNA -hPa RNA -2 和 hBr RNA -hPa RNA -4间存在强烈的相似性;IM mBr RNA -0 和 IM hBr RNA -hPa RNA -1及 hBr RNA -hPa RNA-5存在强烈的相似性;SSL mBr RNA-1/3与 hBr RNA -hPa RNA -3中相对较小的群体的相似性(图4P)。这些结果强烈提示成纤维细胞对不同组织类型的上皮肿瘤反应存在明显的进化保守性。
为明确上述得到的CAFs异质亚群在肿瘤进展中的作用,作者使用FAK敲除和FAK野生型(FAK可影响CAFs异质性)Rainbow小鼠中建立了同种异体移植乳腺癌,发现FAK-/-和 FAK+/+小鼠的肿瘤侵袭性存在显着差异(FAK-/-小鼠肿瘤明显变大,图5A)。使用条件性基因修饰小鼠,调控FAK在成纤维细胞上的表达(αSMA CreERT2和Col1 CreERT2 )后构建乳腺癌模型,进行单细胞测序显示,肿瘤建立10天后,Col1 CreERT2 小鼠上,FAK KO后CAFs亚细胞6号簇缺失,其主要表达MR相关基因;同时5号簇也有大量缺失,其主要表达IM CAFs的标志性基因(图5B和5C)。同时FAK在成纤维细胞的缺失会导致肿瘤生长加剧,上述结果提示CAFs细胞亚群比例的改变可显著影响实体瘤的进展。作者对其既往收集的接受免疫检查点治疗前后的基底细胞瘤病人单细胞测序结果进行回顾性分析后发现(图5D-E),对鉴定所得的成纤维细胞同样可以分为5个亚细胞簇,根据其基因表达情况可归类为本文中的3中主要CAFs亚型(图5F)。对治疗前后的效果分析显示,肿瘤的免疫治疗可能可以通过调控MR或IM CAFs的功能实现对实体瘤的治疗(图5D-F)。这部分结果强烈提示,调控CAFs亚群的比例/功能可影响实体瘤的进展(图5G)。
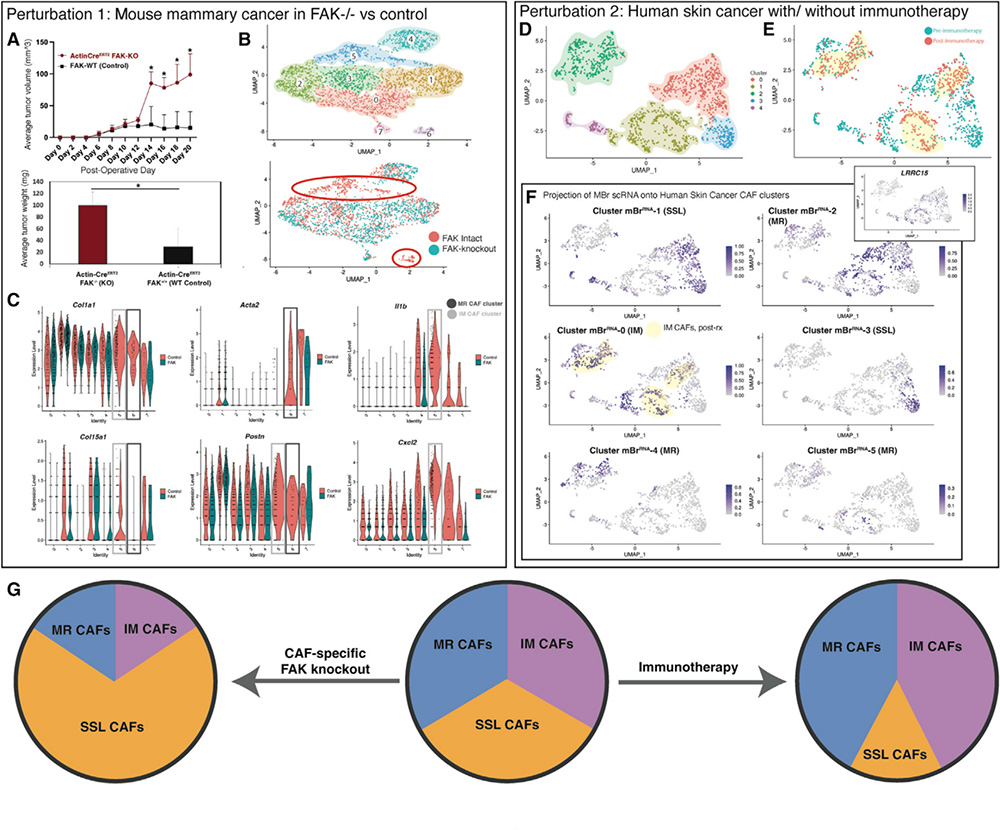
总的来说,本文通过多组学联合分析,鉴定出了在多种组织类型和物种间都保守的3个CAFs亚群,并通过动物实验和既往的治疗案例分析,初步明确了干预CAFs亚群的比例和/或功能可影响实体瘤进展。这一研究一方面加深了我们对CAFs异质性的认知,另一方面也为肿瘤的诊治提供了新思路和新靶点。
主要参考文献:
[1] Park D, Sahai E, Rullan A. SnapShot: Cancer-Associated Fibroblasts. Cell. 2020 Apr 16;181(2):486-486.e1. doi: 10.1016/j.cell.2020.03.013. PMID: 32302576.
[2] Dominguez CX, Müller S, Keerthivasan S, Koeppen H, Hung J, Gierke S, Breart B, Foreman O, Bainbridge TW, Castiglioni A, Senbabaoglu Y, Modrusan Z, Liang Y, Junttila MR, Klijn C, Bourgon R, Turley SJ. Single-Cell RNA Sequencing Reveals Stromal Evolution into LRRC15+ Myofibroblasts as a Determinant of Patient Response to Cancer Immunotherapy. Cancer Discov. 2020 Feb;10(2):232-253. doi: 10.1158/2159-8290.CD-19-0644. Epub 2019 Nov 7. PMID: 31699795.
[3] Buechler MB, Pradhan RN, Krishnamurty AT, Cox C, Calviello AK, Wang AW, Yang YA, Tam L, Caothien R, Roose-Girma M, Modrusan Z, Arron JR, Bourgon R, Müller S, Turley SJ. Cross-tissue organization of the fibroblast lineage. Nature. 2021 May;593(7860):575-579. doi: 10.1038/s41586-021-03549-5. Epub 2021 May 12. PMID: 33981032.
[4] Helms EJ, Berry MW, Chaw RC, DuFort CC, Sun D, Onate MK, Oon C, Bhattacharyya S, Sanford-Crane H, Horton W, Finan JM, Sattler A, Makar R, Dawson DW, Xia Z, Hingorani SR, Sherman MH. Mesenchymal Lineage Heterogeneity Underlies Nonredundant Functions of Pancreatic Cancer-Associated Fibroblasts. Cancer Discov. 2022 Feb;12(2):484-501. doi: 10.1158/2159-8290.CD-21-0601. Epub 2021 Sep 21. PMID: 34548310.
[5] Granja JM, Corces MR, Pierce SE, Bagdatli ST, Choudhry H, Chang HY, Greenleaf WJ. ArchR is a scalable software package for integrative single-cell chromatin accessibility analysis. Nat Genet. 2021 Mar;53(3):403-411. doi: 10.1038/s41588-021-00790-6. Epub 2021 Feb 25. Erratum in: Nat Genet. 2021 Jun;53(6):935. PMID: 33633365