APOE4通过少突胶质细胞的胆固醇失调损害髓鞘形成
点评理由:该研究分析客观全面,逻辑性强,涵盖了体内实验、体外实验、分子途径以及认知行为机制,结论具有说服力。
晚发性阿尔茨海默病(AD,Alzheimer’s disease)占该病的95%以上,全球约有5000万病例。遗传相关的AD占到50%~80%。APOE4(apolipoprotein E-4)是一种脂质和胆固醇的转运蛋白,被认为是阿尔茨海默病最强的遗传危险因素[1]。APOE4与主要等位基因APOE3的不同之处在于单个氨基酸从Cys112变为Arg112,其中APOE3/4会使AD发生的风险增加3-4倍,APOE4/4则会增加8-12倍的风险[2]。
APOE4等位基因存在于40-50%的 AD个体中[3]。既往研究标明,APOE4与淀粉样β沉积增加、tau蛋白的过度磷酸化和聚集以及认知衰退加速有关[4],然而,APOE4介导这些作用的机制尚不完全清楚。这些未知限制了为携带 APOE4 和其他AD患者开发靶向治疗药物的机会,因此,阐明 APOE4 致AD相关发病机制的分子和细胞途径,可以为大部分 AD患者提供治疗希望。
近日,由美国麻省理工学院和哈佛布罗德研究所的Manolis Kellis和Li-Huei Tsai教授领衔的团队,在《Nature》期刊发表了重要的研究成果。他们通过多种分析方法发现:
1、APOE4会改变人和小鼠少突胶质细胞中胆固醇的生物合成、转运和定位;
2、APOE4与内质网(ER)应激和髓鞘形成减少有关;
3、促进胆固醇转运的药物可以增加老年 APOE4/4 小鼠的髓鞘形成,并且改善小鼠的学习和记忆能力。
以上结果为APOE4、胆固醇积累、髓鞘形成和 AD 发病机制之间的联系提供了新见解,并且为AD疾病的治疗提供了新机会。
本研究从多角度对研究结论进行了证实,共涵盖了体外实验(死亡人体标本和多能干细胞(iPS)研究)和体内实验(动物实验)。
作者团队首先希望获得的是,APOE4携带者的生物学表型结果,便进行了基于死亡人体前额皮层(PFC,prefrontal cortex)组织的转录组学分析。本分析共纳入了32个个体,其中包括12个APOE3/3携带者、12个APOE3/4携带者和8个APOE4/4携带者。获取每个个体的死后PFC样本进行转录学分析。最终基于snRNA-seq技术,共获得了178789个单核细胞核转录组数据。
为更全面地进行分析,作者团队希望获得对人体PFC内的细胞种类。于是进行了基于图形的聚类分析,区分出低丰度细胞和高丰度细胞,将研究对象聚焦于代表性更好、重复性更高的高丰度细胞(包括兴奋性(NRGN+)神经元、抑制性(GAD1+)神经元(SYT1+)、星形胶质细胞(AQP4+)、少突胶质细胞(MBP+)、少突胶质前体细胞(OPCs)(VCAN+)、小胶质细胞(CSF1R+)和异质性血管细胞类型群体)。
在确定了单细胞核转录数据和细胞种类后,团队随后进行了APOE4相关的通路水平改变分析。通过使用控制多变量线性模型,比较了APOE3/4和APOE4/4与APOE3/3的通路活性评分,最终共鉴定出486个候选的APOE4扰动的分子过程,包括404条细胞类型特异性通路和82条广泛失调性通路。这些通路改变大致分为了炎症和免疫相关通路的上调、突触相关通路的下调,以及细胞应激和能量代谢通路改变。这一结果与已建立的APOE4神经生物学报道的结果类似[5]。
接下来,作者团队为了继续APOE4-脂质的相关机制研究,进行了更窄的靶向通路分析,将目光聚焦于脑特异性脂质相关通路。进一步优先考虑了17个受APOE4影响的脂质相关通路,揭示了胆固醇、类固醇、磷脂、糖脂、脂肪酸和甘油三酯代谢的细胞类型特异性改变(图1)。
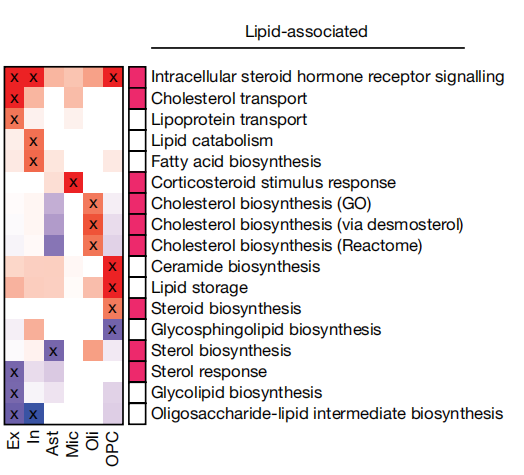
图1.APOE4相关表达改变的脑特异性脂质相关通路(标注X为P<0.05,线性模型,APOE3/3与APOE3/4和APOE4/4)
团队在结果中发现,携带APOE4的少突胶质细胞中,编码胆固醇生物合成相关典型酶(如DHCR24、HMGCS1、SQLE和MVK)的基因上调,这与既往研究报道中的AD与少突胶质细胞的密切关系[6]一致。鉴于这种新出现的关联,团队集中于研究少突胶质细胞中APOE4和胆固醇之间的关系。结果显示,APOE4与少突胶质细胞中胆固醇相关基因的表达增加有关,呈剂量依赖性(APOE4/4>APOE3/4>APOE3/3,P=0.01,Pearson相关性)(图2),这与APOE4对AD风险的剂量依赖性效应相似,表明APOE4调节少突胶质细胞中的胆固醇可能导致AD。并且排除了AD诊断对于胆固醇相关基因表达的影响。这表明APOE4对脂质和胆固醇代谢具有非病理学依赖性作用,胆固醇生物合成增加可能是APOE4和AD病理诊断的会聚途径。
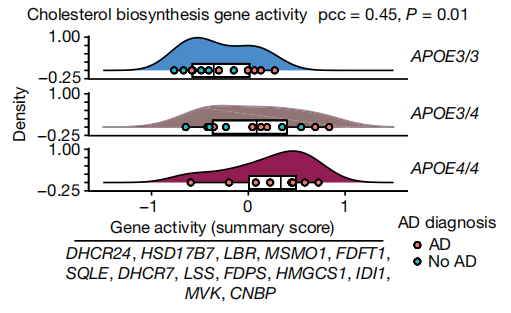
图2.APOE4改变人死后少突胶质细胞中胆固醇的稳态和定位。APOE4与人死后少突胶质细胞胆固醇生物合成基因聚集表达呈剂量依赖性关联(APOE4/4>APOE3/4>APOE3/3,Pearson相关系数(pcc)=0.45,P=0.01,双侧)。
后续作者又继续报道了胆固醇和脂质合成、储存或转运相关的基因在APOE3/4和APOE4/4与APOE3/3死后少突胶质细胞中差异表达(FDR<0.05,负二项混合模型)的具体类型。其具体结果为:与胆固醇生物合成和液滴形成相关的基因上调(DHCR24、LPIN2、IRS2、NR1H2、LBR、LPIN1和MBTPS1),而与胆固醇转运相关的基因下调(PCYT1B、SEC23A、PRKN、SCP2和LPCAT3)。(图3)
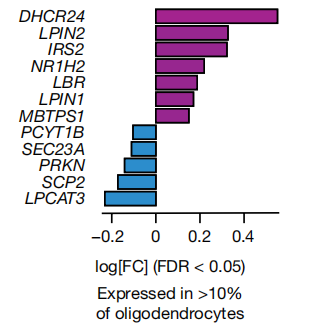
图3.人死亡后APOE3/3与APOE3/4和APOE4/4少突胶质细胞差异表达的胆固醇相关基因(snRNA-seq数据,FDR校正P<0.05,负二项混合模型)
随后的脂质组学分析结果和包含314例个体PFC的额外分析结果也证实了APOE4脑组织中胆固醇酯可能升高。(图4)
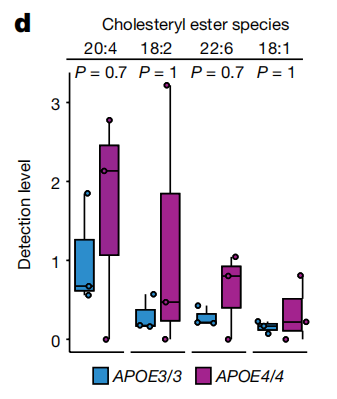
图4.基于MS分析APOE3个体(APOE3/3,女性,n=3)和APOE4携带者(APOE4/4,女性,n=3)死后人胼胝体定量4种胆固醇酯的检测水平测定
随后进行的体外iPS研究显示,与APOE3/3对照相比,APOE4/4少突胶质细胞中88种脂质增加(校正P<0.05),只有一种减少(图5)。这些结果进一步证明了APOE4少突胶质细胞增加了细胞内胆固醇的储存,证实并扩展了在人死亡后PFC中所观察到的结果。
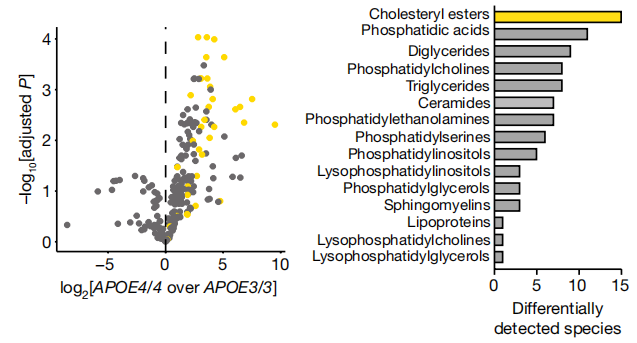
图5.iPS细胞来源的APOE3/3和APOE4/4少突胶质细胞基于MS的脂质组学分析中检测到的脂质种类浓度。胆固醇酯物质以黄色突出显示。每个脂类的差异数量都被展示出来(校正P<0.05)。胆固醇酯是最常检测到的差异类别,在APOE4少突胶质细胞中有15个物种上调。
脂滴的积累是内质网应激的共同标志。随后,作者团队希望探究APOE4少突胶质细胞内脂质聚集的具体位置以及与内质网应激的关系。结果显示,与APOE3/3对照相比,人APOE4/4少突胶质细胞表现出ATF6介导的内质网应激途径上调,同时,APOE4/4少突胶质细胞中与内质网胆固醇转运相关的基因(PCYT1B、SEC23A、SCP2和LPCAT3)下调,提示内质网应激和胆固醇转运受损可能在观察到的细胞内胆固醇积累中具有核心作用。为了检测这种可能性,后续进行了iPS细胞来源分析,结果表明聚集在APOE4/4少突胶质细胞中的细胞内胆固醇大多数保留在内质网中。总之,这些结果证明APOE4与少突胶质细胞质膜中胆固醇定位减少、胆固醇酯和脂滴增加以及内质网应激上调有关。
随后作者希望探究APOE4与髓鞘形成之间的关系。少突胶质细胞使中枢神经系统髓鞘化,胆固醇的生物利用度则是髓鞘形成和维持的限速因素。作者团队推断,APOE4少突胶质细胞中胆固醇定位和稳态的改变可能会损害髓鞘形成。结果显示,与APOE3/3死后人少突胶质细胞相比,APOE3/4和APOE4/4死后人少突胶质细胞表现出髓鞘相关基因的下调(PLLP、MYRF、MAG、OPALIN、MOG和PLP1)。同时,基于BlackGold II染色方法的分析结果显示,携带APOE4的人类大脑中髓鞘水平降低;体外实验结果也显示,APOE4/4-TR小鼠的髓轴突数量减少。(图6)
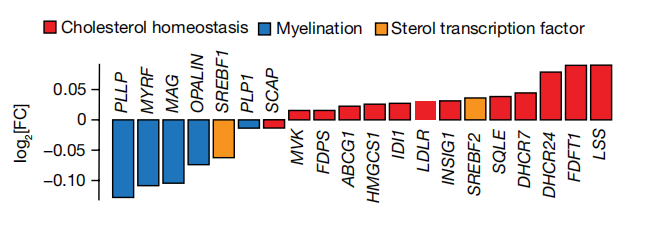
图6.APOE3/3、APOE3/4和APOE4/4人死后少突胶质细胞中髓鞘相关或胆固醇相关基因的差异表达
为了探究,少突胶质细胞中APOE4的较少髓鞘形成是否收到其他机制影响,是否是蛋白质功能受损的结果,作者进行了基于iPS的实验。结果证明,APOE4少突胶质细胞因相关蛋白质抑制,转运胆固醇的能力受损,可能会减少髓鞘形成,且不受到其他因素的影响。
由上可知,少突胶质细胞中APOE4的表达促进胆固醇积聚和髓鞘形成受损。因此,作者推断,抑制APOE4/4少突胶质细胞中胆固醇生物合成和/或促进胆固醇转运,可能减少细胞内蓄积并改善髓鞘形成。环糊精是一种促进胆固醇转运的药物。作者进行了基于iPS细胞的体外实验和APOE4/4-TR小鼠体内实验。结果显示,环糊精的确降低了APOE4少突胶质细胞中的脂类蓄积,成功改善了髓鞘形成。
为了进一步探究在环糊精处理的APOE4/4-TR小鼠中观察到的髓鞘形成增加是否与小鼠功能改善相关,作者进行了学习和记忆能力的分析。共纳入对照组APOE4/4-TR小鼠(n=12)和环糊精处理组APOE4/4-TR小鼠(n=14)。结果显示,环糊精治疗确实可以改善老年APOE4/4-TR小鼠的学习和执行功能。(图7)
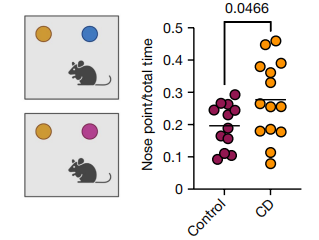
图7.环糊精可改善老年APOE4小鼠的髓鞘形成和学习记忆。对照(n=12)和环糊精处理(n=14)APOE4/4-TR雌性小鼠的新对象识别任务示意图。通过将动物用鼻子探索新物体的时间除以小鼠与任一物体相互作用的总时间计算偏好。数据点代表个体小鼠。条形代表平均值。使用Welch校正的非配对双尾Student t检验计算P值。
总之,该研究通过将人死后大脑的转录组学和脂质组学分析,与使用等基因干细胞系和基因敲入小鼠模型的功能研究相结合,从分子途径到认知行为机制上剖析了APOE4的细胞类型特异性效应。发现APOE4会改变人脑中多种细胞类型的脂质和胆固醇稳态,尤其是少突胶质细胞中胆固醇基因表达和定位失调,导致髓鞘形成障碍,而药理学促进胆固醇外流在体外和体内增加髓鞘形成,可以改善APOE4/4-TR小鼠的认知。
这些综合研究结果,建立了APOE4、胆固醇转运和少突胶质细胞定位、髓鞘损伤和认知能力之间的机制联系,给阿尔茨海默病提供了治疗和诊断机会。胆固醇转运可能是治疗髓鞘形成受损的靶点或切入点,同时是否携带APOE4基因可以为这种治疗方法提供更多依据。
参考文献
[1]. Lambert JC, Ibrahim-Verbaas CA, Harold D, et al. Meta-analysis of 74,046 individuals identifies 11 new susceptibility loci for Alzheimer's disease. Nat Genet. 2013 Dec;45(12):1452-8. doi: 10.1038/ng.2802. Epub 2013 Oct 27. PMID: 24162737; PMCID: PMC3896259.
[2]. Corder EH, Saunders AM, Strittmatter WJ, et al. Gene dose of apolipoprotein E type 4 allele and the risk of Alzheimer's disease in late onset families. Science. 1993 Aug 13;261(5123):921-3. doi: 10.1126/science.8346443. PMID: 8346443.
[3]. Crean S, Ward A, Mercaldi CJ, et al. Apolipoprotein E ε4 prevalence in Alzheimer's disease patients varies across global populations: a systematic literature review and meta-analysis. Dement Geriatr Cogn Disord. 2011;31(1):20-30. doi: 10.1159/000321984. Epub 2010 Dec 1. PMID: 21124030.
[4]. Liu CC, Zhao N, Fu Y, et al. ApoE4 Accelerates Early Seeding of Amyloid Pathology. Neuron. 2017 Dec 6;96(5):1024-1032.e3. doi: 10.1016/j.neuron.2017.11.013. PMID: 29216449; PMCID: PMC5948105.
[5]. Yamazaki Y, Zhao N, Caulfield TR, et al. Apolipoprotein E and Alzheimer disease: pathobiology and targeting strategies. Nat Rev Neurol. 2019 Sep;15(9):501-518. doi: 10.1038/s41582-019-0228-7. Epub 2019 Jul 31. PMID: 31367008; PMCID: PMC7055192.
[6]. Mathys H, Davila-Velderrain J, Peng Z, et al. Nature. 2019 Jun;570(7761):332-337. doi: 10.1038/s41586-019-1195-2. Epub 2019 May 1. Erratum in: Nature. 2019 Jun 17;: PMID: 31042697; PMCID: PMC6865822.