全身性接种诱导CD8+T细胞并重塑肿瘤微环境
点评理由:肿瘤微环境限制治疗性抗癌疫苗对T细胞的功能的调控,但相关抑制机制尚不清楚。该研究发现对理解癌症疫苗和免疫疗法具有广泛的意义,突出了免疫激活调节肿瘤微环境以实现最佳T细胞功能的必要性,为肿瘤免疫治疗找到了一种有前途的方法。
癌症免疫疗法的关键是利用患者自身免疫系统来调节肿瘤消退。抗肿瘤免疫反应的核心是T细胞,它能以抗原特异性的方式杀死肿瘤细胞。治疗性癌症疫苗的主要目标是通过诱导体内抗原特异性T细胞来促进肿瘤退化[1]。然而,肿瘤微环境(TME)内的抑制机制可能限制T细胞功能[2]。因此,更好地了解肿瘤免疫环境对提高个性化抗癌疫苗的效力至关重要。
近日,由美国国家卫生研究院疫苗研究中心的Robert A. Seder领衔的研究团队在《Cell》期刊发表最新研究成果,他们评估了疫苗接种途径如何改变肿瘤内微环境。他们使用将肿瘤抗原肽与Toll样受体7/8激动剂连接的自组装纳米颗粒疫苗(SNP-7/8a),于皮下(SNP-SC)或静脉(SNP-IV)治疗荷瘤小鼠。这两种途径都产生浸润肿瘤的抗原特异性CD8+T细胞。然而,只有SNP-IV介导的肿瘤消退,依赖于增强免疫时的I型干扰素。单细胞RNA测序显示,SNP-IV增强后,表达免疫调节基因标记(Chil3等)的肿瘤内单核细胞减少。Chil3+单核细胞基因标记在CD16–单核细胞中富集,并与更坏的结局相关。他们的结果表明,特异性CD8+T细胞的产生和TME的重塑是肿瘤免疫治疗的一种有前景的方法。
研究者们此前曾报道,皮下注射SNP-7/8a可生成新生抗原(neoAg)特异性CD8+T细胞,这些细胞根据转录谱进行最终分化[3]。据此,他们从SNP-IV对全身性先天免疫激活的影响中描绘了CD8+T细胞数量和质量的作用。他们将小鼠皮下植入MC38肿瘤,并在第7天(初始免疫)和第14天(增强免疫)用含有肿瘤特异性抗原(Reps1)的SNP-7/8a和抗PD-L1治疗(图1A)。与他们先前的数据一致[3],接受SNP-IV介导的肿瘤消退,而接受SNP-SC不能控制肿瘤生长(图1B)。然而,首先用SNP-SC激发,然后用SNP-IV增强的小鼠也可以控制肿瘤并促进生存,类似于两次给予SNP-IV(图1C)。这些数据表明,启动时不需要SNP-IV,SNP-SC产生的终末分化CD8+T细胞也可以在SNP-IV刺激下介导肿瘤消退。
用不含Reps1的SNP-SC和含有MC38抗原的SNP-IV引发的小鼠也不能有效控制肿瘤生长(图1D)。为了评估增强免疫时对抗原的需求,用含有Reps1的SNP-SC和含有无关抗原的SNP-IV对小鼠进行预处理(图1E)。值得注意的是,SNP-SC为引后用不相关的抗原进行SNP-IV增强免疫,提高了对肿瘤生长的控制和50%的存活率(图1F)。这些数据表明,SNP-SC一次产生的neoAg+CD8+T细胞足以在全身固有刺激后介导肿瘤消退,即使在增强免疫时没有抗原。此外,增强的抗肿瘤作用并非TLR7/8a信号所独有,因为在SNP-SC预处理后静脉(IV)给药polyIC:LC(另一种诱导IFN-I信号的佐剂)也可以显著介导肿瘤消退,并延长SNP-SC启动后7天的生存期(图1E和1F)。
为了评估SNP-SC或SNP-IV增强后neoAg+CD8+T细胞的数量是否存在差异,他们在增强后一周的第21天采集全血,并通过流式细胞术测量四聚体+群体(图1G)。与仅接受一次含有Reps1的SNP-SC的小鼠相比,在增强时接种含有不相关抗原或polyIC:LC的SNP-IV组,neoAg+CD8+T细胞的数量没有增加(图1H)。总之,SNP-SC引发的neoAg+CD8+T细胞可能会促进抗肿瘤效果。
由于CD8+T细胞的耗竭标志物和抗原经验对于提高免疫检查点阻断的治疗效果很重要,他们评估了疫苗接种后PD-1、TIM-3和NKG2A的表达。与接受SNP-IV或polyIC:LC IV的其他组相比,SNP SC增强的细胞显示耗竭标记物PD-1、TIM-3和NKG2A的表达更高(图1I)。然而,无论接受何种治疗,肿瘤浸润的Reps1+CD8+T细胞显示PD-1、TIM-3、NKG2A和CD39的表达水平相似(图1J)。总的来说,CD8+T细胞,尤其是肿瘤中耗竭标记物的表达没有显著差异,这表明SNP-IV或polyIC:LC给予IV的全身先天性刺激可能影响T细胞以外的免疫细胞。
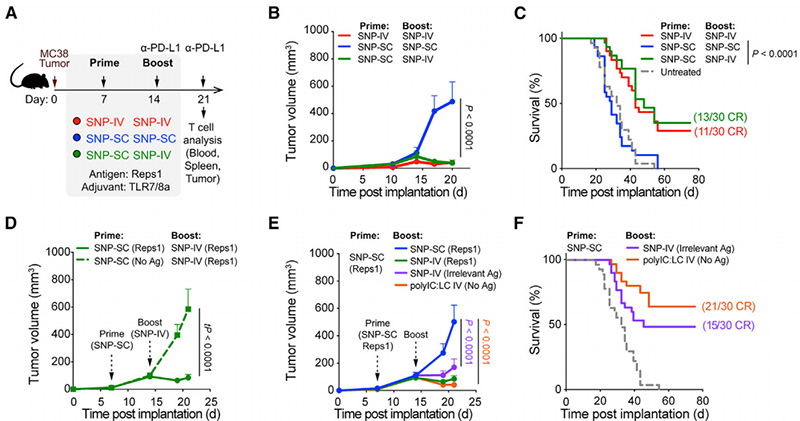
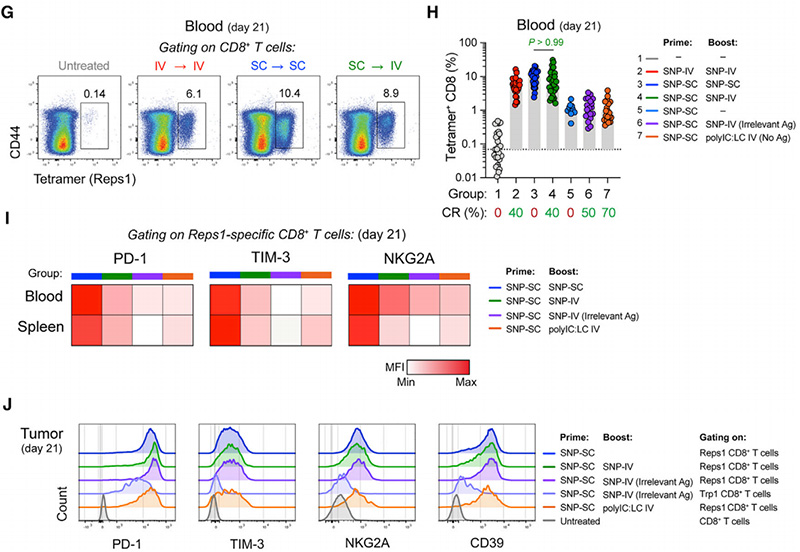
图1 产生的肿瘤特异性CD8+T细胞控制肿瘤生长
为了进一步证明SNP-SC或SNP-IV增强之间可能影响抗肿瘤免疫的差异,他们进一步对疫苗药代动力学进行了追踪。SNP-IV后通过体内成像检测到疫苗的全身分布,但SNP-SC未检测到(图2A)。此外,荧光标记的疫苗可以主要在第一小时内定位在肿瘤中,并在24小时后以低水平保持可检测(图2B)。对接种后移植肿瘤和肿瘤训练淋巴结(tdLN)的评估证实了SNP-IV而非SNP-SC接种后荧光标记疫苗的检测结果(图2C)。与实时成像数据一致的是,接种后6小时,CD45+白细胞隔室内可检测到vaccine+细胞群(图2D)。在肿瘤、tdLNs和脾脏中,包括单核细胞、单核细胞衍生的DC(moDC)、cDC1s和cDC2s在内的多个不同髓系细胞群体已接种疫苗(图2E)。
考虑到SNP-IV而非SNP-SC后疫苗的全身分布,他们评估了接种后6小时小鼠血清中促炎细胞因子的水平(图2F)。与SNP-SC相比,SNP-IV后,ELISA检测到高水平的全身IFNα和IL-12(图2F)。由于已知IFNa促进CD8+T细胞启动的cDC1s的抗原交叉呈递[4],他们在接种后24小时量化了脾脏、肿瘤和tdLNs中的cDC1。与他们先前的观察结果一致[3],SNP-IV后脾脏和肿瘤中的cDC1数量减少(图2G)。在脾脏和肿瘤中观察到SNP-IV后成熟cDC1的比例高于SNP-SC和tdLNs(图2H,2I)。总之,SNP-7/8a的IV给药导致全身疫苗分布,包括脾脏、肿瘤和tdLNs,其中DC可以经历成熟以促进新抗原特异性CD8+T细胞的许可。
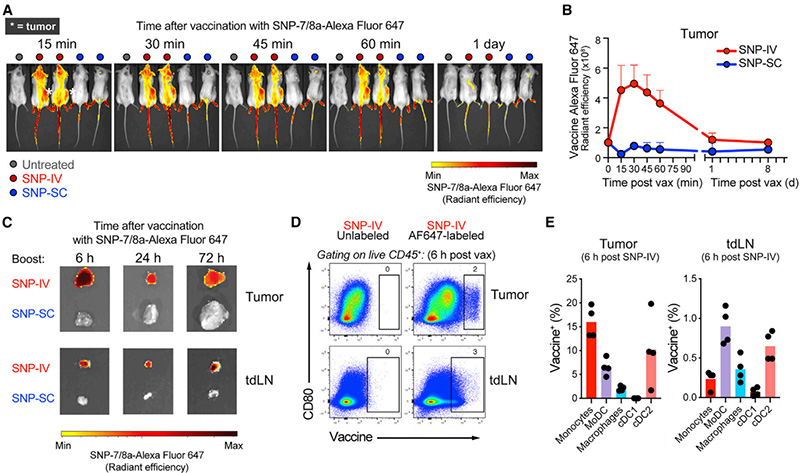
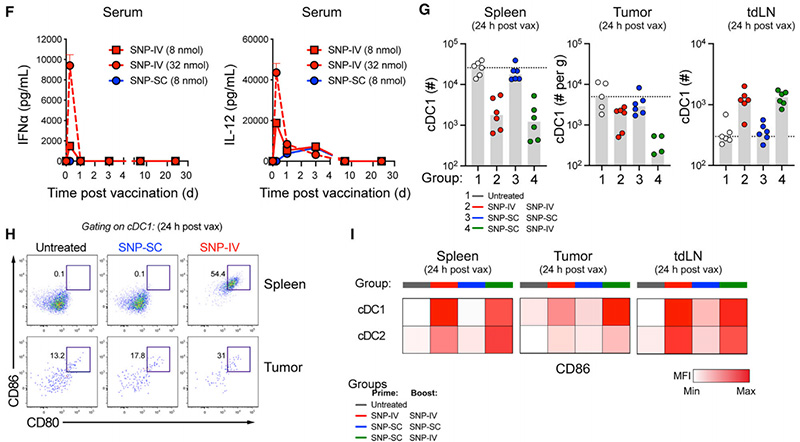
图2 SNP-IV而非SNP-SC导致肿瘤内疫苗分布和DC成熟
为了进一步表征TME中发生的免疫反应,他们在用含有Reps1的SNP-SC或SNP-IV或含有无关抗原(Trp1)的SNP-IV增强24小时后收集肿瘤。根据表达CD11b/CD11c的造血CD45+细胞,通过流式细胞术对髓样细胞进行分类,以获得足够的细胞数量,用于下游分析(图3A)。以单核细胞、巨噬细胞和树突状细胞为重点,通过UMAP降维识别并可视化了19个“原始簇”,并简化为9个“元簇”(图3B和3C)。尽管所有9个元簇都存在于脾脏和肿瘤中,但TME主要由单核细胞和巨噬细胞组成(图3D)。基于细胞周期分析,由于与G2/M期相关的基因的高表达,他们将Mac-1鉴定为巨噬细胞的增殖亚群。然后,他们分别基于C1qb、Plin2、Ace和Chil3(YM1)的高表达来注释Mac-2、Mac-3、Mono-1和Mono-2(图3E)。
他们发现了一种与抗肿瘤效果相对应的模式:未经SNP-SC增强的动物显示出肿瘤中Chil3+单核细胞的富集,而SNP-IV(Reps1)和SNP-IV增强的组中Plin2+巨噬细胞富集(图3F)。事实上,SNP-IV增强的动物体内Plin2+巨噬细胞的频率显著增加(图3G)。与他们的流式细胞术数据一致,SNP-IV后在脾脏和肿瘤中观察到mregDCs的富集[5](图3G)。
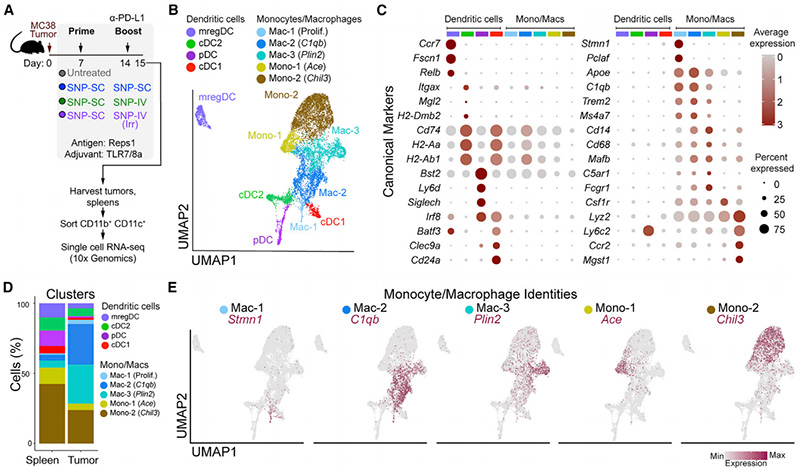
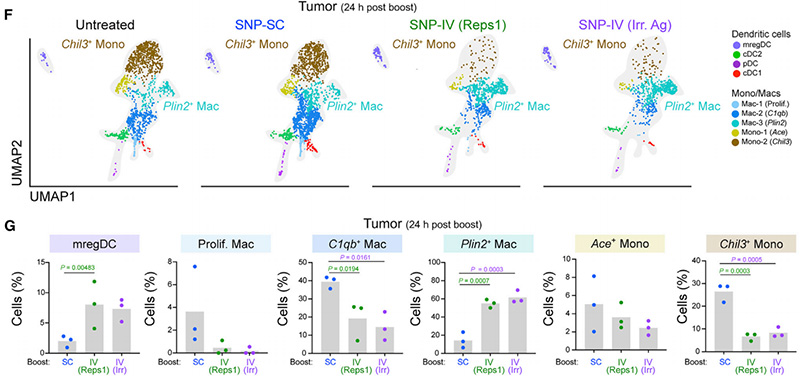
图3 SNP-IV后肿瘤内的Chil3+单核细胞显著减少
考虑到各组单核细胞和巨噬细胞转录谱的显著差异,他们对肿瘤内单核细胞/巨噬细胞室进行了进一步研究,以了解它们在每个亚群中的独特基因特征和富集途径(图4A)。SNP-IV后有100多个基因上调,而SNP-SC后只有40个基因上调(图4B)。在顶部差异表达基因中,Plin2+巨噬细胞上调了与干扰素信号相关的基因,包括Irf7、Cxcl2、Ifitm1和Isg15,而Chil3+单核细胞上调了与调节或抑制活性相关的基因(图4C和4D)。总之,观察到的各组间基因表达差异进一步证实了SNP-IV后巨噬细胞表达干扰素刺激基因和SNP-SC后单核细胞表达调节基因的模式。
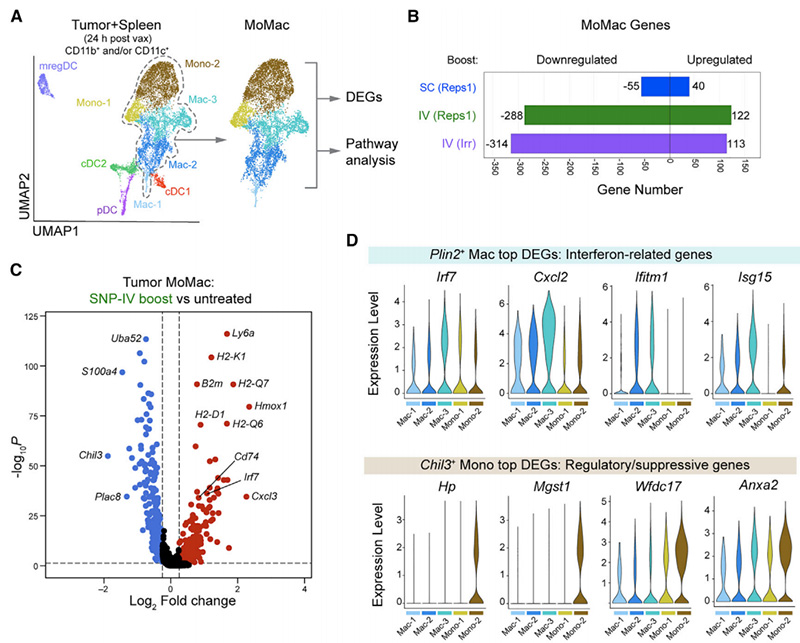
图4 Chil3+单核细胞表达与免疫调节反应相关的基因标记
最后,他们分析了由61353个细胞组成的人类单核-巨噬细胞图谱的癌症数据集(图5A),发现了各种huChil3基因的富集,偏向单核细胞而非巨噬细胞(图5B)。huChil3基因集在各种肿瘤中富集于CD16–单核细胞(图5C,D)。他们进而评估了这些观察结果与疾病结果的关系。大量RNA序列样本表明,huChil3基因集富含分选的髓细胞,但不富含T细胞、调节性T细胞或肿瘤细胞(图5E)。这种富集表明,该基因集允许通过反褶积大量RNA-seq数据推断huChil3+单核细胞丰度。因此,他们转向了来自癌症基因组图谱(TCGA)的表达和相关生存数据,并发现在泛TCGA分析中,低huChil3水平与更高的生存率相关。值得注意的是,包括透明细胞肾细胞癌(ccRCC)和低度胶质瘤(LGG)在内的一部分癌症适应症偏离了上述总体观察结果,其中huChil3的高表达而非单核细胞的普遍表达与更差的结果相关(图5F)。总之,来自各种人类肿瘤的大规模数据集支持鉴定表达免疫抑制基因的组织单核细胞和由Chil3+单核细胞共享的ANXA2被鉴定为抗肿瘤免疫的负调节因子,可能导致更坏的疾病结局。
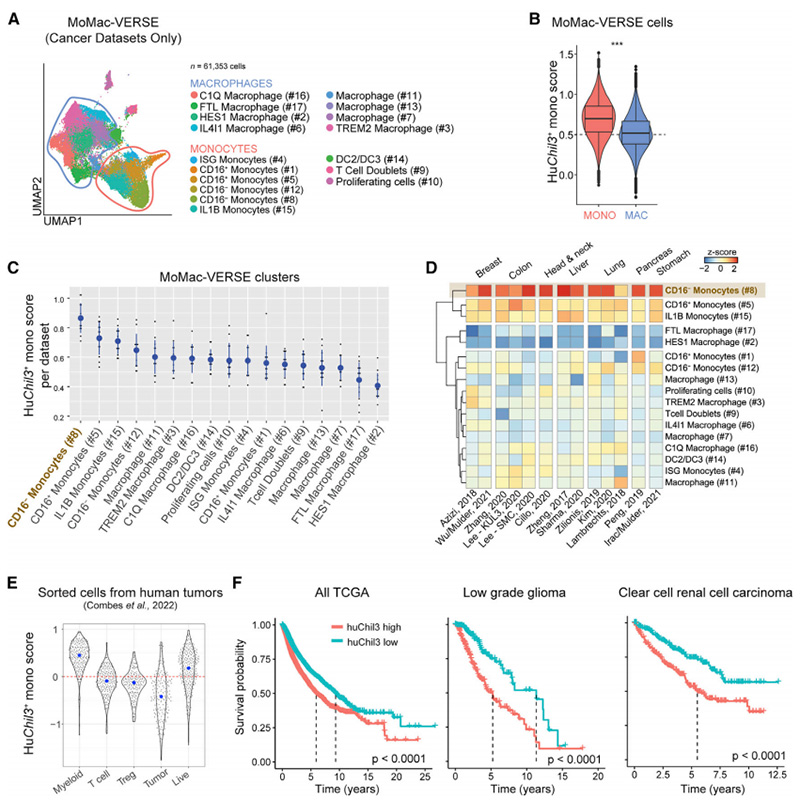
图5 人类肿瘤相关髓系细胞中的Chil3+单核细胞标记物
该研究有一定局限性。首先,观察是在小鼠肿瘤模型中进行的,这些模型无法完全反映人类的肿瘤免疫微环境。与小鼠移植肿瘤相比,患者的关键特征包括肿瘤结构、血管化、生长速度和免疫浸润可能有所不同。其次,他们使用的小鼠肿瘤模型是免疫炎症肿瘤,研究的结果可能无法模拟免疫排斥或免疫沙漠型肿瘤。尽管如此,该研究对理解癌症疫苗和免疫疗法具有广泛的意义,突出了先天免疫激活调节TME以实现最佳T细胞功能的必要性。
参考文献
[1] Saxena M, van der Burg SH, Melief CJM, Bhardwaj N. Therapeutic cancer vaccines. Nat Rev Cancer. 2021 Jun;21(6):360-378. doi: 10.1038/s41568-021-00346-0. Epub 2021 Apr 27. PMID: 33907315.
[2] Mosely SI, Prime JE, Sainson RC, Koopmann JO, Wang DY, Greenawalt DM, Ahdesmaki MJ, Leyland R, Mullins S, Pacelli L, Marcus D, Anderton J, Watkins A, Coates Ulrichsen J, Brohawn P, Higgs BW, McCourt M, Jones H, Harper JA, Morrow M, Valge-Archer V, Stewart R, Dovedi SJ, Wilkinson RW. Rational Selection of Syngeneic Preclinical Tumor Models for Immunotherapeutic Drug Discovery. Cancer Immunol Res. 2017 Jan;5(1):29-41. doi: 10.1158/2326-6066.CIR-16-0114. Epub 2016 Dec 6. PMID: 27923825.
[3] Baharom F, Ramirez-Valdez RA, Tobin KKS, Yamane H, Dutertre CA, Khalilnezhad A, Reynoso GV, Coble VL, Lynn GM, Mulè MP, Martins AJ, Finnigan JP, Zhang XM, Hamerman JA, Bhardwaj N, Tsang JS, Hickman HD, Ginhoux F, Ishizuka AS, Seder RA. Intravenous nanoparticle vaccination generates stem-like TCF1+ neoantigen-specific CD8+ T cells. Nat Immunol. 2021 Jan;22(1):41-52. doi: 10.1038/s41590-020-00810-3. Epub 2020 Nov 2. PMID: 33139915; PMCID: PMC7746638.
[4] Le Bon A, Etchart N, Rossmann C, Ashton M, Hou S, Gewert D, Borrow P, Tough DF. Cross-priming of CD8+ T cells stimulated by virus-induced type I interferon. Nat Immunol. 2003 Oct;4(10):1009-15. doi: 10.1038/ni978. Epub 2003 Sep 21. PMID: 14502286.
[5] Maier B, Leader AM, Chen ST, Tung N, Chang C, LeBerichel J, Chudnovskiy A, Maskey S, Walker L, Finnigan JP, Kirkling ME, Reizis B, Ghosh S, D'Amore NR, Bhardwaj N, Rothlin CV, Wolf A, Flores R, Marron T, Rahman AH, Kenigsberg E, Brown BD, Merad M. A conserved dendritic-cell regulatory program limits antitumour immunity. Nature. 2020 Apr;580(7802):257-262. doi: 10.1038/s41586-020-2134-y. Epub 2020 Mar 25. Erratum in: Nature. 2020 Jun;582(7813):E17. PMID: 32269339; PMCID: PMC7787191.