瘫痪后恢复行走的神经元被发现
点评理由:严重脊髓损伤通常导致瘫痪,该研究发现硬膜外电刺激有望帮助患者恢复活动能力并揭示了背后的神经生物学机制。建立的详细分子图谱和测序方法,将有助于指导未来运动恢复基础回路的研究。
协调行走的神经元位于腰椎。为了行走,大脑通过从脑干级联的下行路径广播命令,以激活这些神经元[1]。严重的脊髓损伤(SCI)中断了从大脑和脑干到腰椎的通路,导致瘫痪。有个案报告称,硬膜外电刺激(EES)可以激活腰椎脊髓中的非功能神经元,使瘫痪患者能够行走。在神经康复期间应用EES(EESREHAB)进一步促进了行走的恢复,即使在刺激关闭时也是如此[2]。但EESREHAB参与并重塑腰椎以恢复行走的生物学原理仍然未知。
近日,由瑞士联邦理工学院生命科学学院的Jocelyne Bloch、 Jordan W. Squair和Grégoire Courtine领衔的研究团队在《Nature》杂志发表重要研究成果,他们在神经康复期间对慢性脊髓损伤患者进行的腰椎时空硬膜外电刺激恢复了患者行走功能。这种恢复包括在行走过程中脊髓神经元活动的减少。这种意外的减少反映了特定神经元亚群的活动依赖性选择,这些亚群在脊髓损伤后对患者行走至关重要。最终,他们识别并确定了一个恢复组织神经元亚群,这是瘫痪后恢复行走所必需的。
研究者们首先测试了EESREHAB能否恢复SCI患者行走,以及这种恢复是否涉及到腰椎重塑。9名受试者参加了一项“地面刺激运动”试验,旨在确定EESREHAB的安全性和可行性。EESREHAB将手术植入的神经刺激器与多电极桨状导线相连接,实现对仿生EES协议的闭环控制并支持神经康复[2](图1a)。EES协议立即使所有9名参与者提高或恢复了行走能力。在EESREHAB之前表现出残存功能的参与者的下肢运动得分明显增加,即使在没有EES的情况下,4名参与者的行走功能也能恢复(图1b)。
步行的持续恢复表明EESREHAB重塑了脊髓。他们推测,这种重塑一定反映在行走过程中神经元的活动中。为了探索这种可能性,他们使用18F-氟脱氧葡萄糖摄取的正电子发射断层扫描(18FDG-PET)来量化EESREHAB前后脊髓对行走反应的代谢活性。步行引起腰椎节段内的明显活动(图1c)。出乎意料的是,EESREHAB导致了这种活性的降低(图1c,d)。腰椎脊髓中神经元活动的减少支持了一种假设,即EESREHAB控制了特定神经元亚群的活动依赖性选择,这些亚群对瘫痪后行走至关重要。
他们推断,识别EESREHAB行走恢复过程中选择的神经元亚群需要一个临床前模型,在该模型中可以对基因定义的神经元亚群体进行分类、解剖和操作。因此,他们在小鼠中建立了翻译框架,以复制在人类中EESREHAB的关键技术和治疗特征。小鼠接受了严重的中胸挫伤,其复制了人类SCI最常见的病理生理学(图1e),SCI导致永久性瘫痪(图1f)。EESREHAB协议恢复了所有受试小鼠的行走(图1h)。然后,他们探究了EESREHAB是否如在人类中观察到的那样,在行走过程中诱导小鼠腰椎脊髓神经元活动减少(图1c,d)。为了回答这个问题,他们对cFos进行了全脊髓标记,cFos是神经元活动诱导的转录标记[3]。他们发现,与未进行EESREHAB的小鼠相比,接受EESREHAB小鼠的cFosON神经元数量明显减少(图1g)。这些结果表明,他们的框架概括了在人类中观察到的EESREHAB的关键技术和治疗特征,从而提供了必要的实验条件以确定EESREHAB选择的神经元亚群,以恢复瘫痪后的行走。
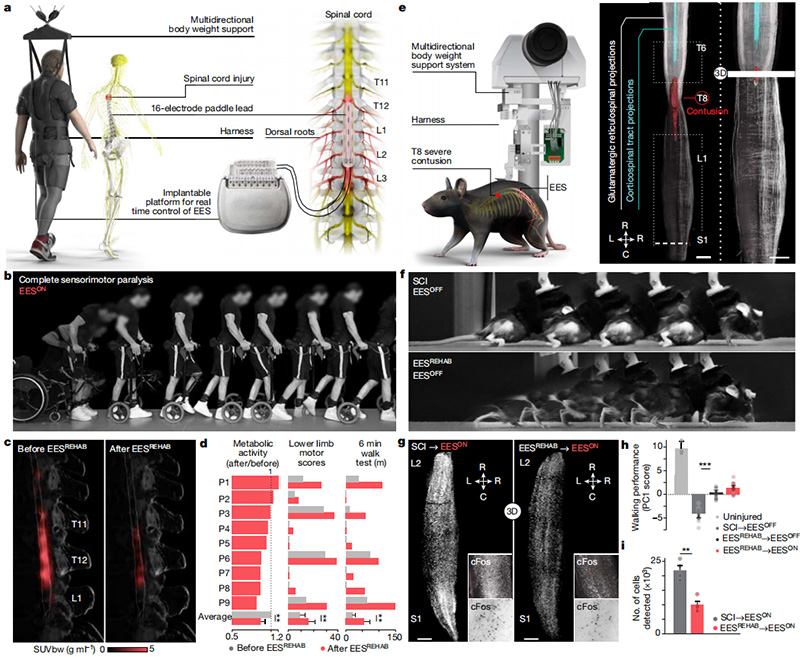
图1 EESREHAB重塑人和小鼠的脊髓
他们预计,识别与EESREHAB结合并重塑的神经元亚群需要一个图谱,该图谱将每个神经元亚群的分子反应分类为EESREHAB的关键治疗特征。为了制作这张图谱,他们利用了高通量技术,使其能够以单细胞分辨率对脊髓进行检查。
他们首先使用单核RNA测序(snRNA-seq)对小鼠的腰椎进行了分析[4]。他们设计了8种实验条件,捕捉了EESREHAB的关键治疗特征(图2a),确定了36个表达经典标记基因的神经元亚群(图2b)。基于背侧和腹侧标志基因的表达检测到脊髓神经元的明显分离(图2b)。这种二分法迫使他们将单细胞制图映射到脊髓的细胞结构上。因此,他们利用空间转录组学来解决EESREHAB关键特征中腰椎基因表达的空间分布[5](图2c)。他们首先验证了背侧和腹侧区域标记基因的预期定位(图2c)。他们发现,通过snRNA-seq鉴定的神经元亚群占据了与它们所分配的转录特性一致的不同的脊髓区域(图2c)。多重RNAscope验证了关键神经元亚群的空间位置(图2c)。这张空间分辨率的腰椎单细胞图谱建立了一种分子地图,以导航瘫痪后恢复行走的未知神经元群体,从而识别恢复组织神经元。
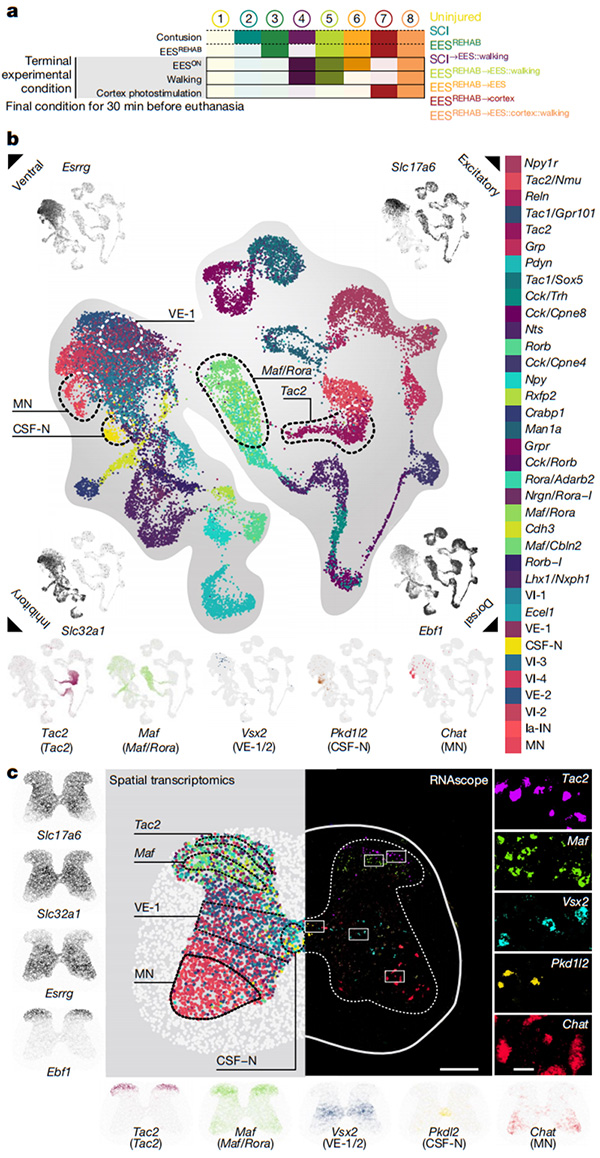
图2 EESREHAB的分子制图
接下来,他们利用这一腰椎综合图谱来识别EESREHAB参与和重塑的神经元亚群。为了克服单基因标记分析低表达的缺点,他们开发并验证了细胞类型优先化的概念,该方法识别了在生物扰动下变得更加转录可分的细胞类型[6]。令人惊讶的是,根据EESREHAB的每一种治疗特征,表达Vsx2和尾侧脊髓神经元标记物(Hoxa10)的两个兴奋性腰脊髓中间神经元群体(SCVsx2::Hoxa10)被优先考虑(图3a,b)。此后,他们开发了一种新方法将细胞类型优先化的概念扩展到空间转录组学,将其命名为Magellan。在脊髓内,Magellan限制了与行走相关的对中间层的扰动反应,这与SCVsx2::Hoxa10神经元的位置以及产生运动的神经元所在的腹侧层位置一致(图3c)。
细胞类型和空间优先数据表明,位于中间层的兴奋性中间神经元是瘫痪后恢复行走的假定神经元。因此,这些神经元可能具有与EESREHAB的关键治疗特征兼容的解剖和功能特征。他们首先探究了SCVsx2::Hoxa10神经元是否具有适当的解剖连接体。单突触限制的跨突触追踪显示,SCVsx2::Hoxa10神经元从位于背根神经节表达小清蛋白的神经元的大直径传入并且位于vGi的神经元接收直接突触投射(图3d)。光遗传学鉴定发现网织脊髓神经元和大直径传入在同一SCVsx2::Hoxa10神经元的子集中引发短潜伏期反应(图3e)。与这种功能连接一致,EESREHAB增加了从大直径传入纤维和网织脊髓纤维到SCVsx2::Hoxa10神经元的突触投射密度(图3f,g)。
他们推测SCVsx2::Hoxa10神经元也会投射到参与行走的神经元上。他们发现,SCVsx2::Hoxa10神经元仅投射到腹侧脊髓,在腹侧脊髓中,它们与52%的谷氨酸能(GluTON)、77%的GABA能(GABAON)和56%的胆碱能(ChATON)神经元建立紧密的突触同位(图3d)。SCI诱导SCVsx2::Hoxa10神经元到腹侧GABAON神经元的突触同位密度显著降低。在经历EESREHAB的小鼠中未观察到这种重组(图3h)。这带来一个问题,如果EESREHAB介导SCVsx2::Hoxa10神经元的活性依赖性选择,那么这些神经元在EESREHAB之后的行走过程中必须保持激活。尽管经历EESREHAB的小鼠在行走过程中cFosON神经元的数量显著减少(图1i),他们发现EESREHAB后SCVsx2::Hoxa10神经元的这种转录活性加倍(图3i)。
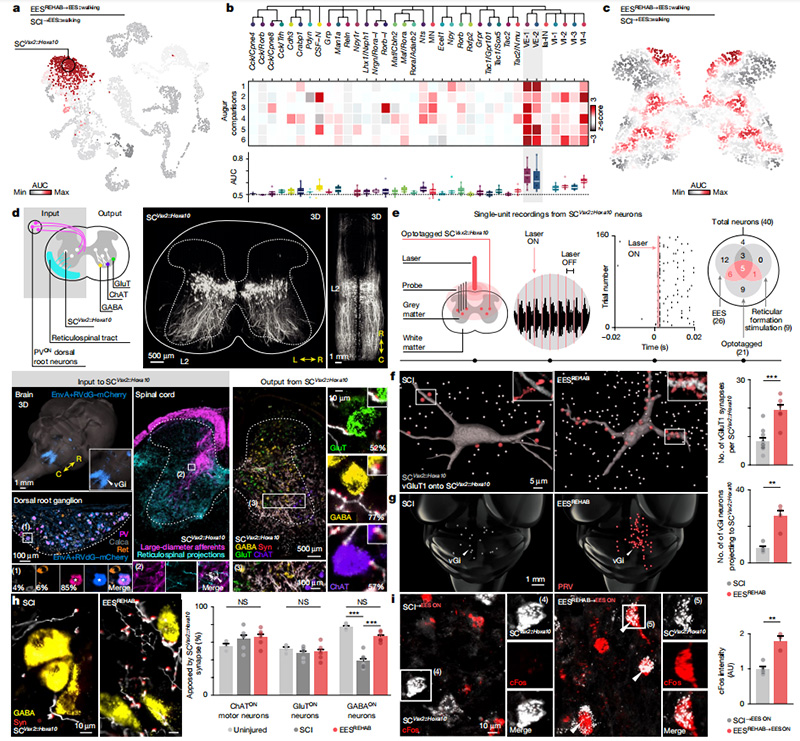
图3 识别恢复组织神经元
进一步地,他们旨在确定SCVsx2::Hoxa10神经元是否必要以恢复瘫痪后的行走。为了探讨EESREHAB后SCVsx2::Hoxa10神经元的作用,他们使用电极增强了脊髓光遗传学无线系统。SCI小鼠中SCVsx2::Hoxa10神经元的光生失活立即抑制了行走。当微型LED关闭时,步行立即恢复(图4a)。化学遗传失活证实了这些结果(图4b)。相反,有慢性麻痹的SCVsx2::Hoxa10神经元的激活立即复制了在经历EESREHAB小鼠中观察到的行走恢复的基本要素,无论EES是打开还是关闭(图4c)。由于SCVsx2::Hoxa10神经元的沉默抑制了SCI后的行走,他们推测并验证了这些神经元的长期沉默会阻止EESREHAB的恢复(图4d)。
他们最后探究了SCVsx2::Hoxa10神经元的作用是否为SCI恢复的基本要求。为了回答这个问题,他们研究了SCVsx2::Hoxa10神经元的消融是否损害脊髓侧半切后自然发生的行走恢复。结果显示在脊髓缺乏SCVsx2::Hoxa10神经元的情况下,小鼠在侧半切SCI后无法完全恢复行走(图4e)。这些实验证实,SCVsx2::Hoxa10神经元的参与是瘫痪后行走恢复的基本要求。
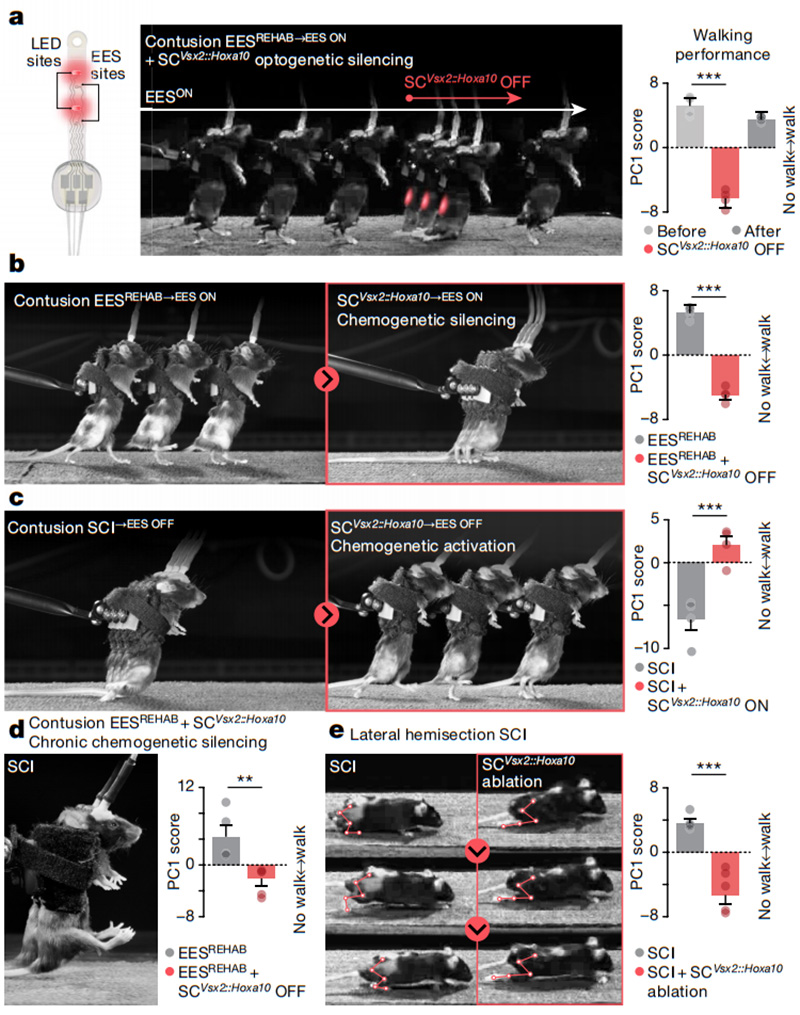
图4 瘫痪后恢复行走需要SCVsx2::Hoxa10神经元
总之,该研究发现EESREHAB改善了SCI患者的神经状态并恢复了行走。这一恢复证明了EESREHAB对SCI后出现神经功能缺损患者的治疗效果,并发现了SCVsx2::Hoxa10神经元在瘫痪恢复过程中发挥的基础作用,从而为临床应用该疗法开辟了道路。
参考文献
[1] Courtine G, Sofroniew MV. Spinal cord repair: advances in biology and technology. Nat Med. 2019 Jun;25(6):898-908. doi: 10.1038/s41591-019-0475-6. Epub 2019 Jun 3. PMID: 31160817.
[2] Wagner FB, Mignardot JB, Le Goff-Mignardot CG, Demesmaeker R, Komi S, Capogrosso M, Rowald A, Seáñez I, Caban M, Pirondini E, Vat M, McCracken LA, Heimgartner R, Fodor I, Watrin A, Seguin P, Paoles E, Van Den Keybus K, Eberle G, Schurch B, Pralong E, Becce F, Prior J, Buse N, Buschman R, Neufeld E, Kuster N, Carda S, von Zitzewitz J, Delattre V, Denison T, Lambert H, Minassian K, Bloch J, Courtine G. Targeted neurotechnology restores walking in humans with spinal cord injury. Nature. 2018 Nov;563(7729):65-71. doi: 10.1038/s41586-018-0649-2. Epub 2018 Oct 31. PMID: 30382197.
[3] Bullitt E. Expression of c-fos-like protein as a marker for neuronal activity following noxious stimulation in the rat. J Comp Neurol. 1990 Jun 22;296(4):517-30. doi: 10.1002/cne.902960402. PMID: 2113539.
[4] Sathyamurthy A, Johnson KR, Matson KJE, Dobrott CI, Li L, Ryba AR, Bergman TB, Kelly MC, Kelley MW, Levine AJ. Massively Parallel Single Nucleus Transcriptional Profiling Defines Spinal Cord Neurons and Their Activity during Behavior. Cell Rep. 2018 Feb 20;22(8):2216-2225. doi: 10.1016/j.celrep.2018.02.003. PMID: 29466745; PMCID: PMC5849084.
[5] Maniatis S, Äijö T, Vickovic S, Braine C, Kang K, Mollbrink A, Fagegaltier D, Andrusivová Ž, Saarenpää S, Saiz-Castro G, Cuevas M, Watters A, Lundeberg J, Bonneau R, Phatnani H. Spatiotemporal dynamics of molecular pathology in amyotrophic lateral sclerosis. Science. 2019 Apr 5;364(6435):89-93. doi: 10.1126/science.aav9776. PMID: 30948552.
[6] Skinnider MA, Squair JW, Kathe C, Anderson MA, Gautier M, Matson KJE, Milano M, Hutson TH, Barraud Q, Phillips AA, Foster LJ, La Manno G, Levine AJ, Courtine G. Cell type prioritization in single-cell data. Nat Biotechnol. 2021 Jan;39(1):30-34. doi: 10.1038/s41587-020-0605-1. Epub 2020 Jul 20. PMID: 32690972; PMCID: PMC7610525.