点评理由:抑郁症是人类最严重的的精神疾病之一,但其背后机制还知之甚少。本研究基于社会地位下调导致抑郁的小鼠模型,阐释了社会竞争挫败和地位下降诱发抑郁状态背后的核心神经机制,为应对人类社会竞争日趋激烈条件下抑郁症高发的态势找到了新对策。
导致人类抑郁的压力多由社会因素引起,其中社会地位的丧失是抑郁症的一个特别突出的风险因素[1]。然而,由于缺乏合适的动物模型,这种社会心理现象背后的神经机制在哺乳动物中尚不清楚。根据进化心理学理论,即社会竞争假说,抑郁状态是一种适应,它能强化失败者的屈服行为,以减少社会对抗成本[1]。因此,抑郁状态可以促进对新建立现状的接受,对个体有利。然而,少有实验直接验证这一假设。
外侧缰核(LHb)被认为与各种生理应激引起的重度抑郁症有关。LHb作为一个反奖赏中枢,被各种厌恶刺激激活,并能抑制与奖赏相关的多巴胺能和血清素能神经元[2]。在物理压力(如反复约束、足电击或化学药物)诱导的类似抑郁的状态下,LHb变得过度活跃,表现出增强的突触效能、兴奋性和爆发性放电[2]。然而,除了身体压力之外,精神压力(如失去社会地位)是否也可能激活LHb诱发抑郁状态仍不清楚。
近日,由浙江大学医学院精神卫生中心胡海岚教授领衔的研究团队在《Cell》期刊发表重要研究成果,她们通过强迫小鼠在一场非暴力的社会竞争中输给低层级小鼠,稳定地降低了其社会等级,并诱导出类似抑郁的行为。她们发现被迫挫败产生负奖励预测误差(RPE)。RPE强烈激活大脑的反奖励中心LHb,LHb的激活抑制了内侧前额叶皮层(mPFC)。mPFC控制着社会竞争力,表现为竞争中的退让。这些结果揭示了社会地位丧失和抑郁行为相互促进背后的核心神经机制。
研究者首先建立了“被迫挫败”的行为范式,在小鼠中诱导社会地位下降(图1A)。她们通过一种标准化的“钻管试验”评定了小鼠在其社会地位的优劣等级。在4只小鼠获得稳定的钻管试验排名后,通过堵塞下级小鼠的试管一侧,迫使最具优势的小鼠(rank1的鼠大哥)输给它的下级(rank2-4的鼠老弟)[3]。因为没有退路,鼠老弟只能向前推鼠老大,才能退出管子。在每天重复该过程10次并持续4天后,先前rank1的鼠大哥的状态降至谷底(图1B)。鼠老弟推挤施加的力逐渐下降(图1C),表明随着时间的推移,鼠大哥变得更容易屈服。逐帧视频分析也显示,在被迫挫败后,鼠大哥在钻管测试中的行为模式发生了巨大变化,推挤更少,后退更多(图1D、1E)。
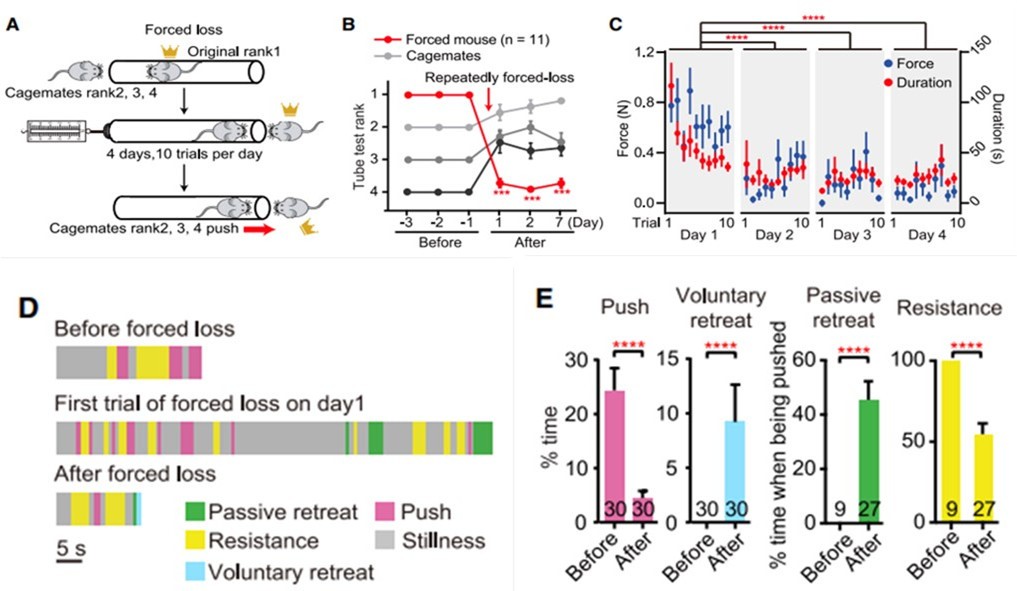
图1 “被迫挫败”范式导致社会地位的稳定丧失
为了研究层级下降对抑郁样行为的影响,她们在被迫挫败后对小鼠进行了强迫游泳测试(FST,测量“行为绝望”)和蔗糖偏好测试(SPT,测量“快感缺乏”)(图2A),被迫挫败个体表现出明显的静止时间增加(图2B)和蔗糖偏好降低(图2C)。值得注意的是,被迫挫败后14天其静止时间仍明显高于对照组(图2D)。
为了确定这些抑郁样行为是否是由失败本身引起的,她们纳入了一组“自然失败”的rank1小鼠和rank4小鼠做对比#,它们习惯于输给更有优势的对手,这些小鼠预期会输。为了进一步排除被迫挫败过程中非社会相关压力的影响,她们还进行了“机械被迫挫败”控制,使用塞子而不是小鼠来诱导失败。这些小鼠对结果没有预期,所以这两种情况都不会触发错误信号。在连续4天每天失败10次后,自然失败组和“机械被迫挫败”组都没有表现出类似抑郁的行为(图2B、2C)。这些数据表明,不是失败本身,而是失败的不可预测的部分(可能是精神心理因素)引发了抑郁样行为。
通过分析影响抑郁样行为严重程度的因素,她们发现FST中的静止时间与被迫挫败试验的平均时间显著相关(图2E)。FST静止时间也与平均推力和rank1的鼠大哥在挫败前保持其优势地位的天数相关(图2F-2H)。因此,被迫挫败期间的努力和以前的支配史可能有助于抑郁症样表型的严重程度。此外,快速抗抑郁药物氯胺酮可逆转强迫损失引起的抑郁样行为,(图2I-2K),这些结果说明该模型对抑郁症的预测有效。
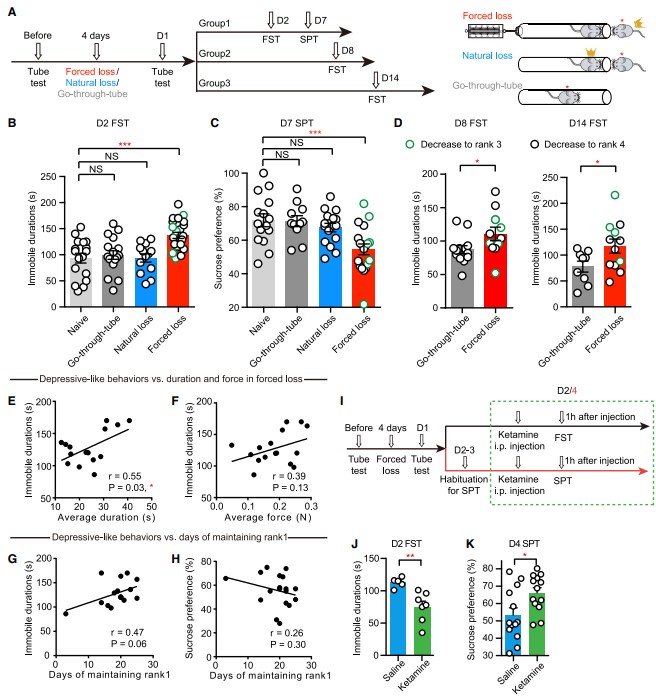
图2 被迫挫败而非自然失败会在优势层级小鼠中诱导抑郁样行为
被迫挫败和自然失败的不同结果使她们假设,被劣势对手击败可能会导致与社会相关的负奖励预测误差(RPE)信号(获胜预期与失败现实之间的差距)。她们对小鼠进行了条件回避测试(CPA),在5次自然或被迫挫败试验后,将小鼠配对到两个室(图3A)。经过被迫挫败而非自然失败小鼠在配对室中的时间显著减少,这反映在负CPA评分中(图3B和3C),表明被迫挫败引起了厌恶状态。她们还让不同等级的小鼠在CPA配对前输给陌生小鼠,发现它们的平均CPA分数与钻管测试等级正相关(图3D-3F)。这表明,等级高的小鼠更容易挫败,而等级低的小鼠可能更能适应失败的经历。
由于LHb与厌恶性情绪刺激的编码有关[2],她们检测了LHb中c-Fos的免疫组化信号,c-Fos是神经兴奋的标记物。虽然自然失败组呈现增加趋势,但被迫挫败组LHb中c-Fos信号明显增多(图3G、3H)。
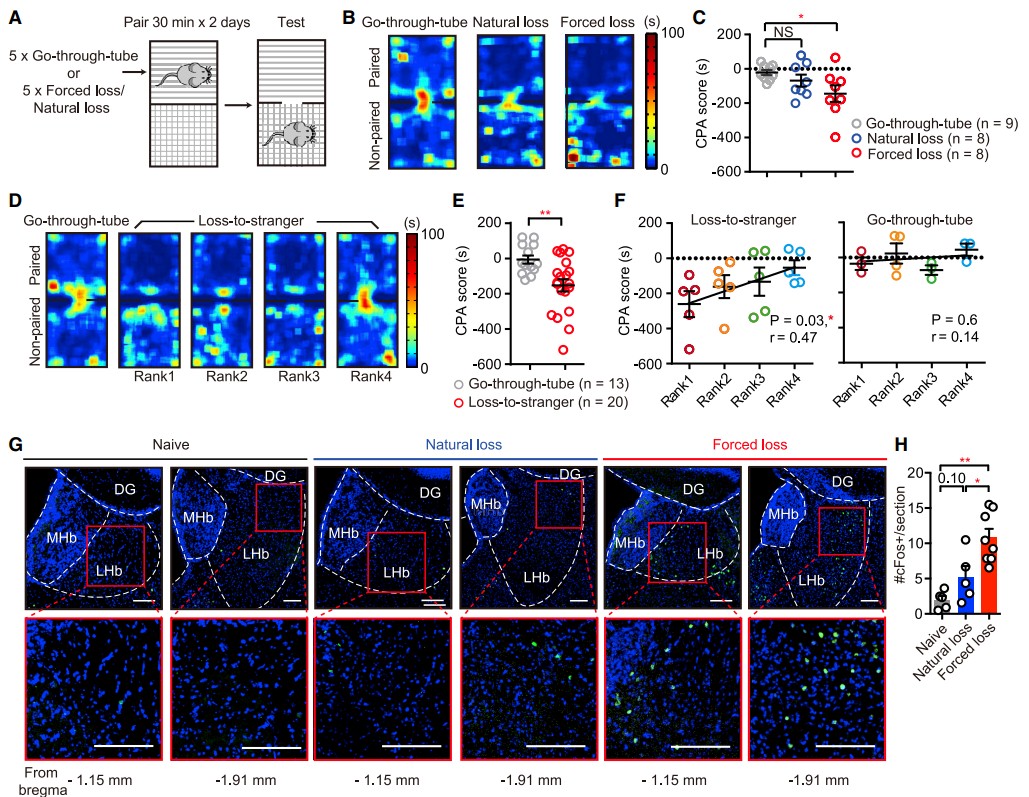
图3 被迫挫败在LHb中诱导负强化效应和c-Fos激活
为了了解被迫挫败期间LHb神经活动的动态变化,她们使用带有CaMKIIa启动子的腺相关病毒(AAV)在rank1鼠大哥的LHb中表达钙指示剂GCaMP6s,并在LHb上安装光纤,用于被迫挫败期间的体内光度测定(图4A、4B),发现LHb神经元被兴奋,“抵抗”和“被动撤退”都与鼠老弟的推动有关(图4C-4E)。
接下来,她们将这些钙信号与自然失败诱导的钙信号进行比较。值得注意的是,在“抵抗”和“被动撤退”时期,对手推挤引起的LHb钙信号仅在被迫挫败组明显,而在自然失败组不明显(图4F-4Q)。这些结果表明,由鼠老弟的意外推动引起的负RPE会强烈激活LHb神经元。
预测误差应该通过经验修正,并随着重复而减少。事实上,在“抵抗”和“被动撤退”时期,鼠老弟推动诱导的鼠大哥钙瞬态的AUC在被迫挫败的4天内有所下降(图4R和4S)。有趣的是,从“退出试管”时期开始的钙瞬变在几天内没有下降(图4T),这表明伴随着地位丧失后的厌恶感在这段时间内没有衰减。
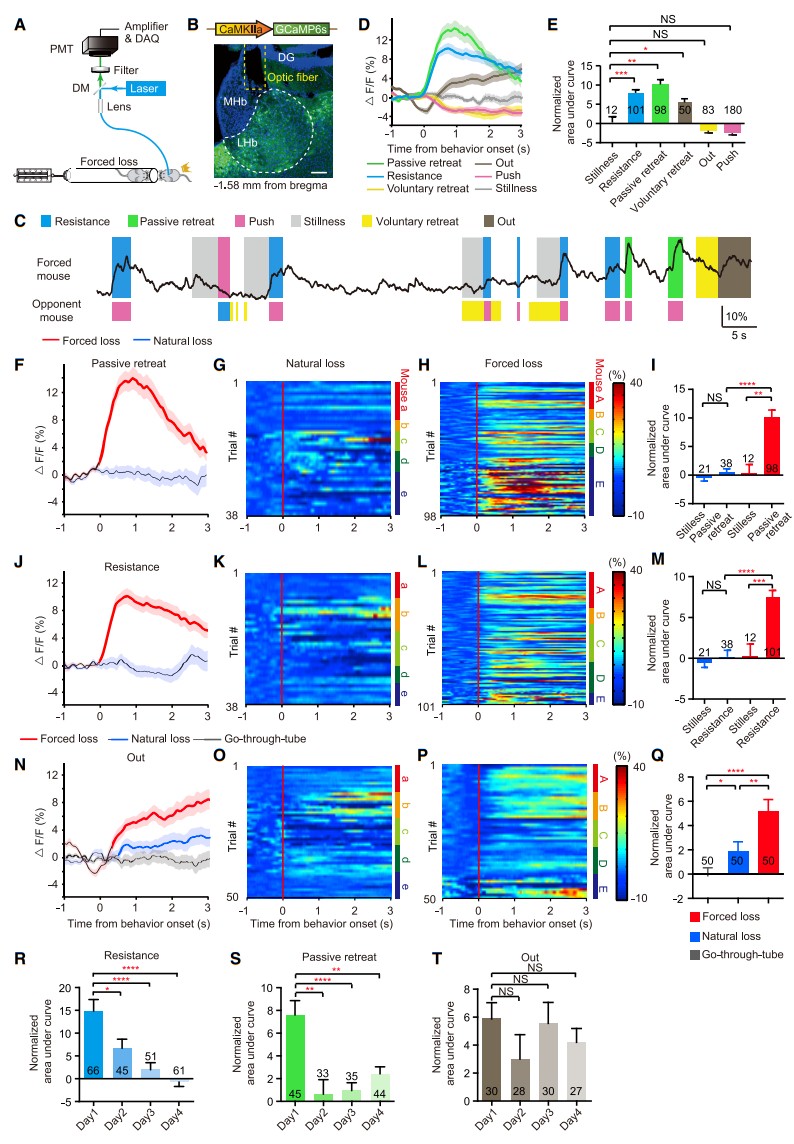
图4 LHb编码了被迫挫败期间的负RPE
接下来,她们试图识别LHb的上游输入可能在强制损耗期间传递负RPE信号。在LHb的主要上游输入中,有两种输入与支配相关的行为密切相关,即内侧前额叶皮层(mPFC)和外侧下丘脑(LH)[4]。为了测试这两种输入通路在被迫挫败诱导的RPE编码中的作用,她们将AAVretro-hSyn-Cre注入LHb,将AAV-CAG-Flex-GCaMP6s注入mPFC/LH,然后在自然和被迫挫败期间监测LHb投射神经元中的钙信号(图5A、5B、5F、5G)。在LH中,只有LHb投射神经元被被迫挫败而非自然失败特异性激活(图5C-5E),而mPFC中则没有LHb投射神经元(图5H-5J),这表明LH-LHb通路在被迫挫败过程中特异性编码预测错误。
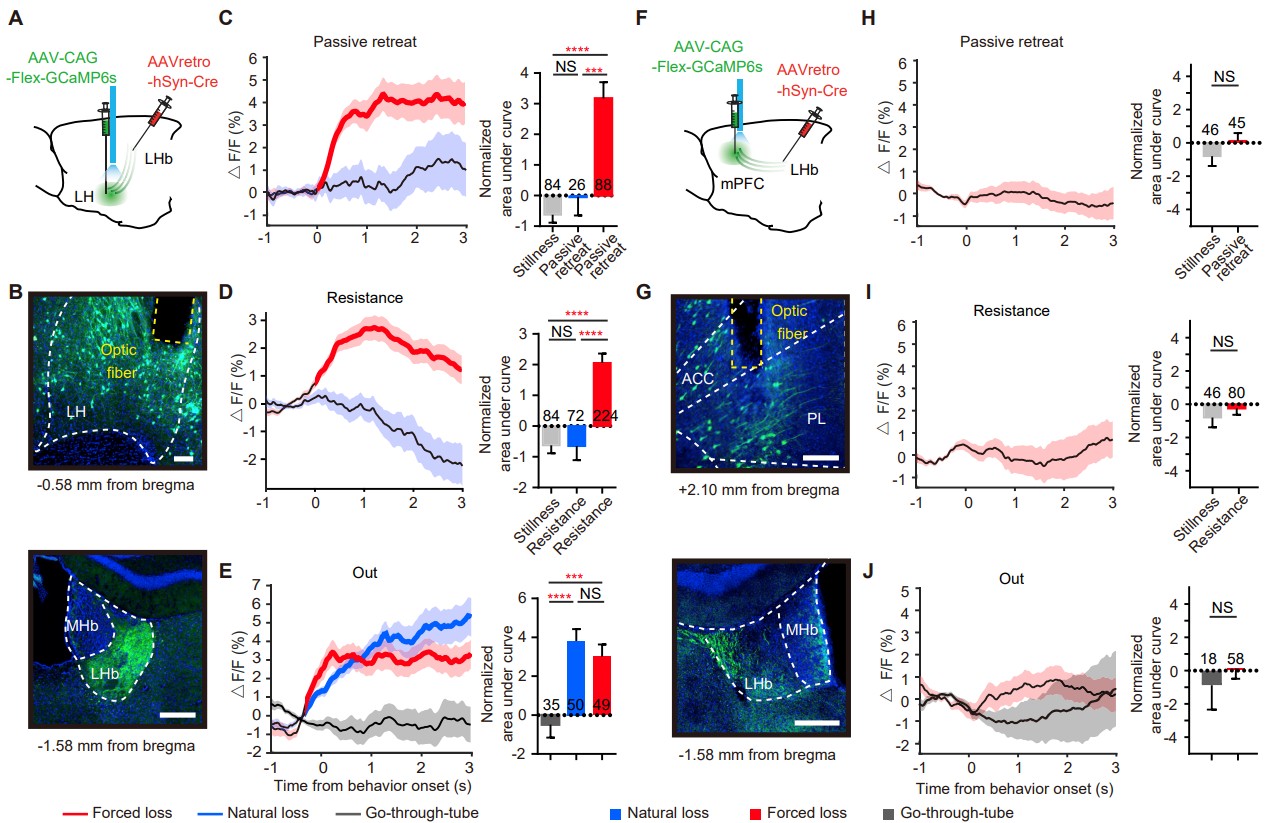
图5 被迫挫败和自然失败时LH-LHb通路的光纤光度测定
为了研究被迫挫败诱导的抑郁样行为是否需要LHb激活,她们应用光遗传学在该过程中抑制LHb。AAV载体与mCherry共同在LHb中表达eNpHR3.0[5](图6A),电生理记录证实了eNpHR3.0在LHb神经元中的抑制作用,鼠大哥稳定维持其rank1位置(图6B)。随后,她们在两只小鼠进入试管后立即打开黄色灯,并在强制试验中一直保持黄光(图6C)。光抑制并不能防止被迫挫败引起的等级下降(图6D),但它导致FST(图6E)和SPT(图6F)的抑郁样表型显著降低。作为对照,在每日被迫挫败后,使用相同的方法抑制LHb神经元并没有减少抑郁样行为(图6G-6J)。
接下来,研究者通过在LH中表达AAV-hSyn-eNpHR3.0-mCherry并在LHb上方植入光纤,以在4天被迫挫败过程中抑制LHb中的LH末端,测试了LH-LHb途径的贡献(图6K和6L)。通过这种操作,小鼠仍然经历了等级下降(图6M),但抑郁样行为表现得更有弹性(图6N和6O)。在mPFC-LHb通路的光遗传抑制中未观察到这种效应(图6P-6T)。这些结果表明,在被迫挫败的过程中,LH-LHb通路的激活对于诱导抑郁样状态是必要的,阻止它可以抵御由失去社会地位引起的抑郁状态。
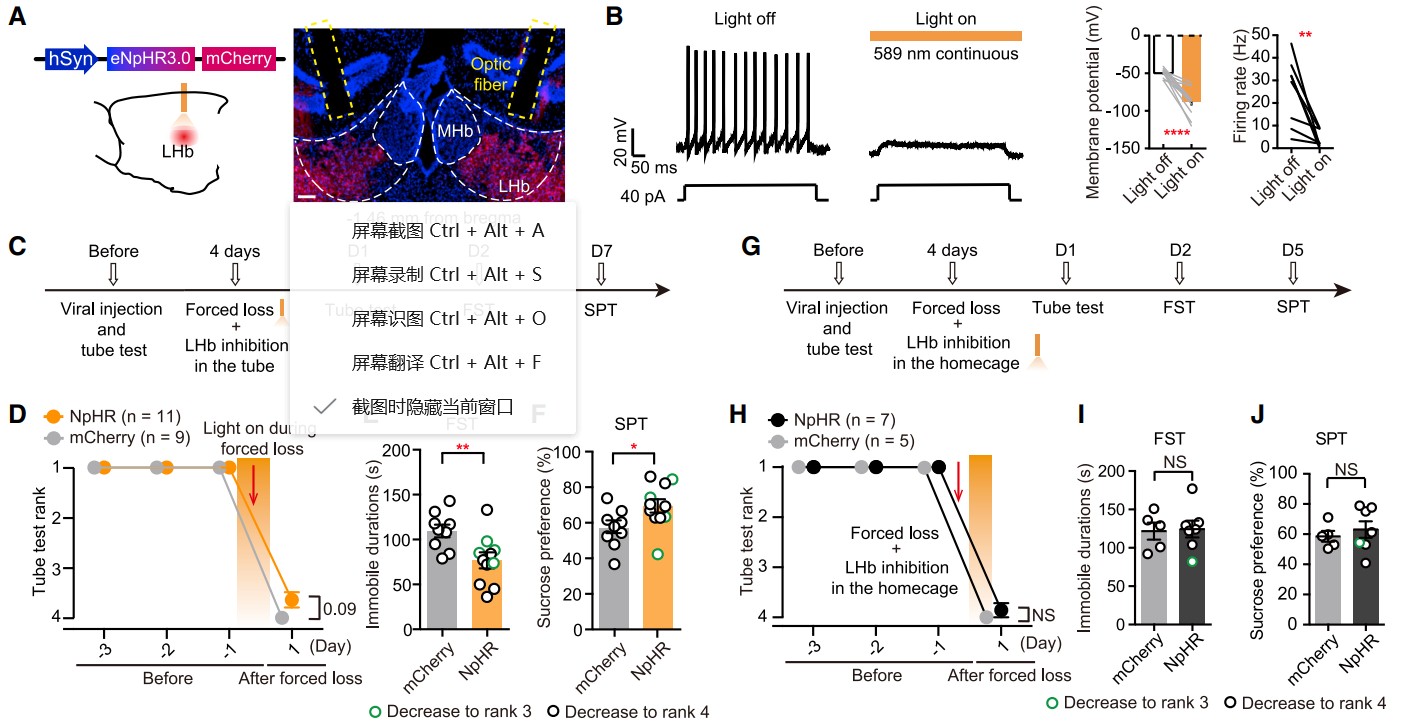
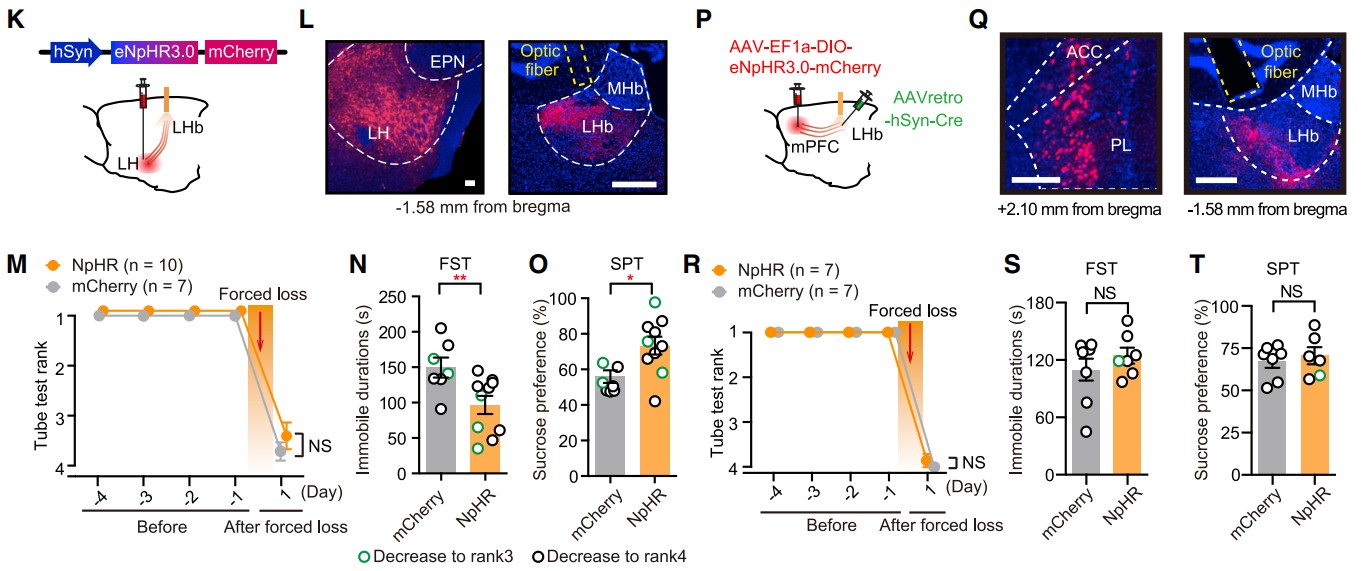
图6 被迫挫败过程中抑制LH-LHb通路可阻止诱导抑郁样行为
该研究具有一定的局限性。首先,“被迫挫败”范式作为抑郁症动物模型只能应用于处于相对优势地位的小鼠。由于等级低的小鼠对压力更有弹性[6],并且习惯了失败,因此被迫挫败不能在这些等级低的小鼠中产生负的RPE并诱发抑郁样行为。此外,该研究仅使用了雄性小鼠,雌性小鼠是否也有类似的神经和行为影响仍需进一步研究。
#“自然失败”为在竞争中低层级小鼠本就可以逐渐击败高层级小鼠,这对高层级小鼠来说就可归为自然失败;“被迫挫败”为在竞争中低层级小鼠本不能够击败高层级小鼠,但是在人为因素干扰下低层级小鼠表现更强烈的进攻态势,进而导致高层级小鼠的被迫挫败。
参考文献
[1] Price J, Sloman L, Gardner R Jr, Gilbert P, Rohde P. The social competition hypothesis of depression. Br J Psychiatry. 1994;164(3):309-315. doi:10.1192/bjp.164.3.309
[2] Flanigan ME, Aleyasin H, Li L, et al. Orexin signaling in GABAergic lateral habenula neurons modulates aggressive behavior in male mice. Nat Neurosci. 2020;23(5):638-650. doi:10.1038/s41593-020-0617-7
[3] Bicks LK, Peng M, Taub A, Akbarian S, Morishita H. An Adolescent Sensitive Period for Social Dominance Hierarchy Plasticity Is Regulated by Cortical Plasticity Modulators in Mice. Front Neural Circuits. 2021;15:676308. Published 2021 May 12. doi:10.3389/fncir.2021.676308
[4] Kingsbury L, Huang S, Wang J, et al. Correlated Neural Activity and Encoding of Behavior across Brains of Socially Interacting Animals. Cell. 2019;178(2):429-446.e16. doi:10.1016/j.cell.2019.05.022
[5] Gradinaru V, Thompson KR, Deisseroth K. eNpHR: a Natronomonas halorhodopsin enhanced for optogenetic applications. Brain Cell Biol. 2008;36(1-4):129-139. doi:10.1007/s11068-008-9027-6
[6] Larrieu T, Cherix A, Duque A, et al. Hierarchical Status Predicts Behavioral Vulnerability and Nucleus Accumbens Metabolic Profile Following Chronic Social Defeat Stress. Curr Biol. 2017;27(14):2202-2210.e4. doi:10.1016/j.cub.2017.06.027