点评:冠状动脉疾病是世界范围内威胁人类健康的头号杀手,全基因组关联研究虽然已经鉴定了数百个致病的风险位点,但相关机制仍知之甚少。本研究提供了支持PDGFD作为冠状动脉疾病风险位点的基因证据,并揭示了其在介导血管平滑肌特异性表型变化和斑块生物学中的作用。
据预测,未来20年内冠状动脉疾病(CAD)仍将是人类死亡的主要原因。全基因组关联研究(GWAS)已经鉴定了数百个导致CAD遗传风险的基因组位点[1]。虽然到目前为止只研究了其中少数位点,但越来越清楚的是,平滑肌细胞(SMC)、内皮细胞和巨噬细胞通过由剧烈细胞状态变化介导的表型转变,在发病风险中起着重要作用[2]。
血小板源性生长因子(PDGFs)与血管壁发育及动脉粥样硬化的病理生理学有关。PDGF家族由4个配体A-D组成,形成二聚体蛋白,通过两个酪氨酸激酶受体PDGFRA和PDGFRB发出信号。最近发现PDGFD可以结合PDGFRB同型二聚体、pdgfr-PDGFRB异型二聚体等。在GWAS研究中,编码PDGFD的位点已被确定与CAD风险相关[3]。然而,关于PDGFD在动脉粥样硬化中发挥作用的生物学研究尚未开展。
近日,由斯坦福大学心血管医学部的Thomas Quertermous教授领衔的研究团队在《Nature Communications》期刊发表重要研究成果,他们通过精细定位方法证明PDGFD是该位点CAD的致病基因,并进一步探究了由于FOXC1/C2在rs2019090相关变体上的差异结合引起的关联机制。他们发现Pdgfd促进SMC谱系细胞向软骨肌细胞表型的扩张、迁移和转变。Pdgfd还增加了表皮成纤维细胞和周细胞的趋化因子和白细胞粘附分子的表达。这些发现表明PDGFD通过促进SMC的有害表型改变以及主要集中在外膜的炎症反应来介导CAD风险。

研究者们对前期筛选的人类冠状动脉平滑肌细胞(HCASMC)中的候选遗传变体[4]进行了优先排序。GWAS发现11q23.2上有6个高连锁不平衡的CAD SNPs与CAD风险相关。其中一个SNPs rs2019090位于长链非编码RNA (lncRNA) AP002989.1内含子PDGFD下游150千碱基处,位于ATAC-seq鉴定的开放染色质和增强子相关H3K27ac组蛋白修饰的HCASMC峰,与CAD转录因子(TFs) TCF21和SMAD3的ChIP-seq峰并列(图1a-c)。
NHGRI-EBI GWAS目录中的GWAS数据也表明其与颈动脉内膜内侧厚度(IMT)有关,“A”等位基因被确定为促进CAD的疾病风险。表达数量性状基因座(eQTL)变异分析也认为A等位基因与PDGFD的更高表达以及主动脉组织早期GTEx分析中AP002989.1的表达增加相关[5]。使用locuscompare.com可视化工具将最近的CAD GWAS相关发现与eQTL数据进行映射,显示rs2019090对CAD风险和PDGFD表达的贡献最大(图1d)。
此外,他们检测了rs2019090位点的DNA序列,发现该SNP定位在一个假定的FOXC1/C2结合位点。相关TFs位置权重矩阵(PWMs)搜索发现两个高度同源的TF FOXC1和FOXC2存在显著匹配(图1c,e)。在欧洲人群中,A是参考等位基因,T是备选等位基因,C和G是备选基因。从FOXC1/C2的PWMs中可以看出,A和G在SNP位点上都是常见的,T最不常见,这表明用rs2019090变体将A替换为T会减少FOXC1/C2靶向PDGFD基因的结合和表达(图1e)。
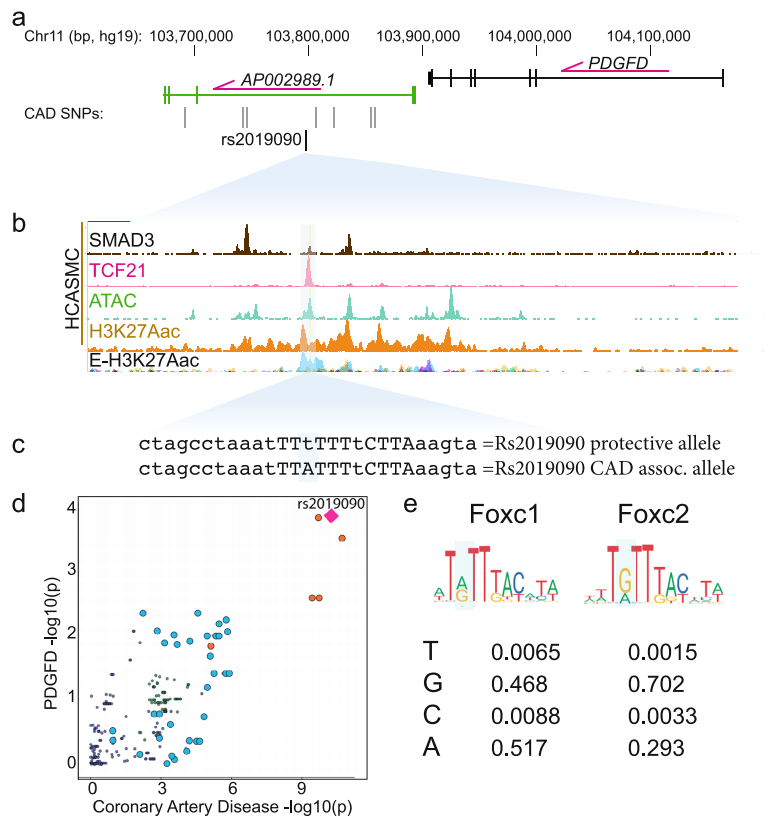
图1 候选11q22.3位点的功能定位提出了PDGFD表达与疾病关联的调控机制
研究者在大鼠血管平滑肌细胞系中通过FOXC1和FOXC2评估了rs2019090增强子区域的等位基因特异性转录。荧光素酶活性表明,过表达FOXC1和FOXC2显著激活了A等位基因,但抑制了T等位基因报告基因,这表明了一种直接的、等位基因特异性的FOXC1和FOXC2(图2a,b)。鉴于FOXC1突变与脑小血管疾病背景下的PDGF信号通路有关,而FOXC2主要与非血管表型相关,研究者着重探究了FOXC1等位基因特异性的顺式效应对内源性PDGFD表达的影响。他们在已知rs2019090位点具有AA、AT或TT基因型的不同HCASMC原发位点进行了敲低(KD)或过表达(OE)。在A/A纯合子和A/T杂合子中,PDGFD的表达均随FOXC1-KD而降低,随FOXC1-OE而升高,但在T/T纯合子HCASMC中不存在这种情况,这表明内源性FOXC1通过SNP rs2019090的A等位基因正调控PDGFD的表达。鉴于rs2019090位于AP002989.1 lncRNA结构中,且eQTL研究已将该lncRNA的剪切与rs2019090的基因型联系起来,他们进行了类似的研究,结果发现与PDGFD表达的结果相反,FOXC1表达的增加或减少都不会改变AP002989.1的mRNA水平(图2d)。
他们进一步探究了FOXC1-PDGFD通路成员之间的调控关系,PDGFD-KD显著增加了FOXC1的表达(图2e,f),这表明这些因素之间存在负向调控相互作用,并支持该通路关系。PDGFD-KD在HCASMC中AP002989.1的表达没有明显变化(图2g)。受体通常被配体水平反调控,他们研究了已知结合PDGFD的两种受体的表达,PDGFRA和PDGFRB受体基因均表现出随着PDGFD的敲除而上调(图2h,i),进一步将这些因素连接到SMC中的功能性PDGFD信号通路中。
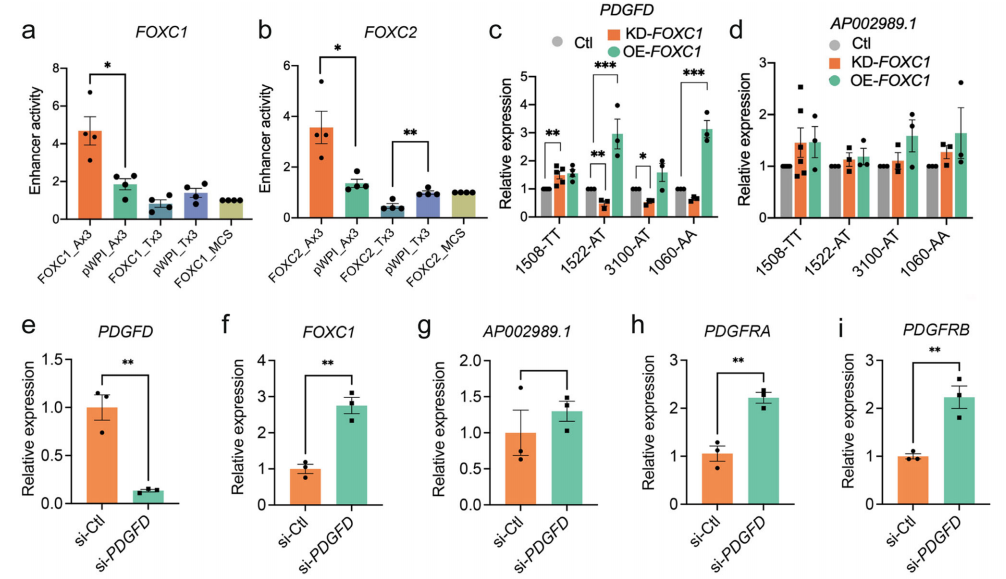
图2 FOXC1通过功能性SNP rs2019090调控PDGFD的表达
为了研究PDGFD调节动脉粥样硬化进程和CAD风险的细胞和分子机制,研究者开发了一种小鼠动脉粥样硬化模型(PdgfdlacZ/ LacZ,Myh11CreERT2,ROSAfloxtdT/+,ApoE−/−,PDGFD KO组)并设置对照组(Pdgfd+/+,Myh11CreERT2, ROSAtdT/+,ApoE−/−,Ctl组)。两组小鼠在8周龄时给予他莫西芬,随后高脂饮食(HFD)喂养16周以诱导动脉粥样硬化(图3a)。对主动脉根部的粥样硬化病变进行解剖后分离KO和Ctl小鼠的主动脉tdT阳/阴性细胞,生成测序文库。
在质量控制评估后,scRNAseq数据使用UMAP降维图进行可视化(图3b),静态和过渡的SMC集群易于从低分辨率参数的其他集群中分离。内皮细胞和成纤维细胞分别形成两个独立的簇,分别为Endo-1 vs Endo-2和Fblst-1 vs Fblst-2。使用特征图可视化Pdgfd和Pdgfb以及Pdgfra和Pdgfrb的簇特异性表达。在对照组织的谱系追踪细胞中,Pdgfd在SMC和FMC中表达,但在CMC中表达水平较低。在非SMC谱系细胞中,其在周细胞、Endo-1和上皮细胞中均有较强的表达,在成纤维细胞中表达较弱(图3c,d)。有趣的是,Pdgfrb在所有SMC系细胞中均有表达。敲除Pdgfd后,SMC明显升高,过渡CMC明显降低(图3e)。
为了检查相对簇细胞数量的变化,他们分别测量了谱系追踪细胞和非谱系追踪细胞在不同簇中的平均细胞百分比。在追踪细胞中,Pdgfd的缺失增加了分化SMC的相对比例,但减少了FMC和CMC簇数量(图3f)。重要的是,在非谱系细胞中,Pdgfd缺失导致巨噬细胞数量减少(图3g)。这些数据表明,在动脉粥样硬化发展过程中,Pdgfd的缺失抑制了SMC表型转变和单核巨噬细胞的募集。
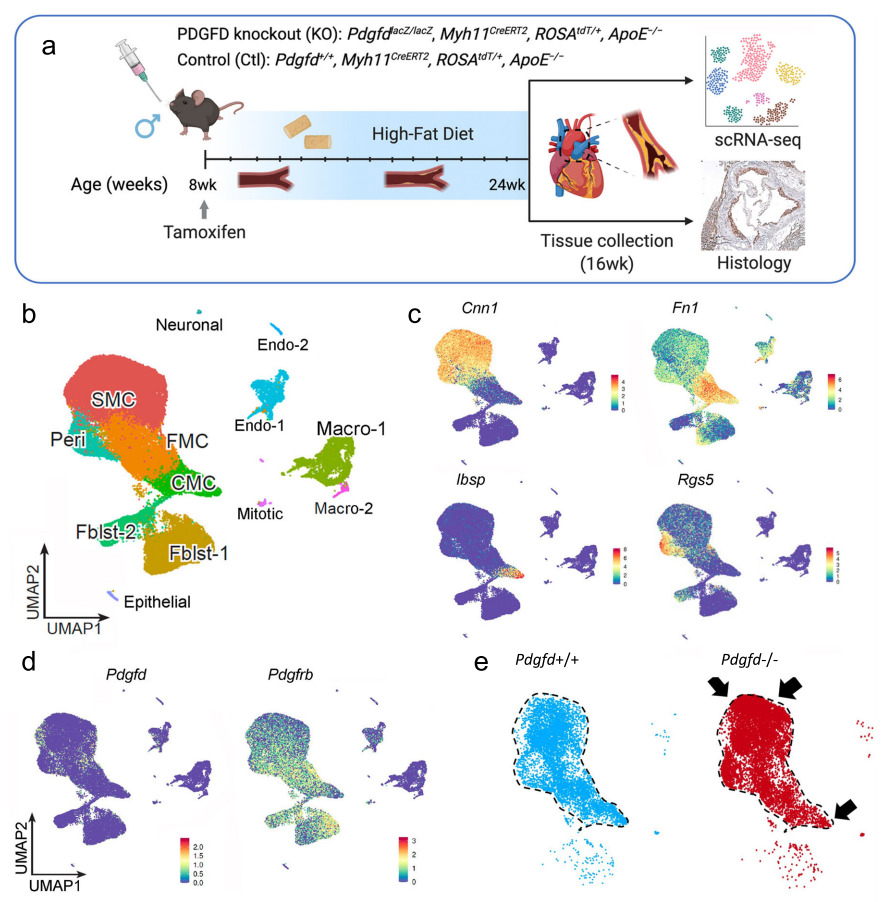
图3 Pdgfd KO小鼠动脉粥样硬化的单细胞转录组分析
利用Seurat的FindMarker算法,研究者分析了Pdgfd缺失与对照相比差异调控的基因,共鉴定出165个转录本(图4a)。在所有细胞表型中,超过一半的上调基因属于静止的SMC(65.5%),而大多数下调基因属于SMC衍生的FMC(32.7%)和CMC(0.3%)和巨噬细胞簇(36.4%)。这些数据表明,Pdgfd增强SMC去分化和表型转变,以及疾病环境中的单核-巨噬细胞募集。他们进一步研究了KO和Ctl组织之间差异表达基因在疾病发病机制中的潜在功能意义。在与纤维化和主动脉瘤形成相关的疾病类别中,差异调控基因富集且高度相互关联(图4b),这表明这些通路与pdgfd介导的动脉粥样硬化相关通路重叠。
为了研究Pdgfd如何特异性地影响表型相似的细胞簇中的基因表达,他们解剖了KO和Ctl组织并比较了单个簇中差异调控基因的数量(图4c,d)。FMC下调的基因在细胞外基质中富集,与早期软骨形成过程相关的基因也富集(图4e)。这些通路中下调的基因包括Col1a1、Col2a1、Col5a1、Thbs1、Ccnd1和Fbn1。
在Pdgfd KO血管组织中,大多数富含CMC调控基因的GO BP反映了该生长因子在SMC向软骨表型转变的突出作用(图4f)。此外,每簇差异调控基因的热图显示FMC和CMC基因表达之间存在显著差异(图4d)。Pdgfd缺失的周细胞中表达下调的基因最多,与SMC差异表达的基因和途径有大量重叠(图4g)。令人惊讶的是,周细胞中有许多基因表达下调,包括Loxl2、Casp4、Col1a1、Thbs1、Timp3、Lox、Fgf2、Fgfr1、Col5a1和Col5a2(图4d)。这些差异调控基因有助于细胞外基质组织的富集、细胞黏附和骨化的正向调控。这些数据表明,Pdgfd激活了与Tgfb信号通路相关的周细胞中的基因表达模式,以及那些被鉴定为SMC转化表型的细胞。对Fblst-1簇基因表达变化的分析表明,Pdgfd在这些细胞中促进了与炎症细胞募集相关的特异性表型程序(图4h)。
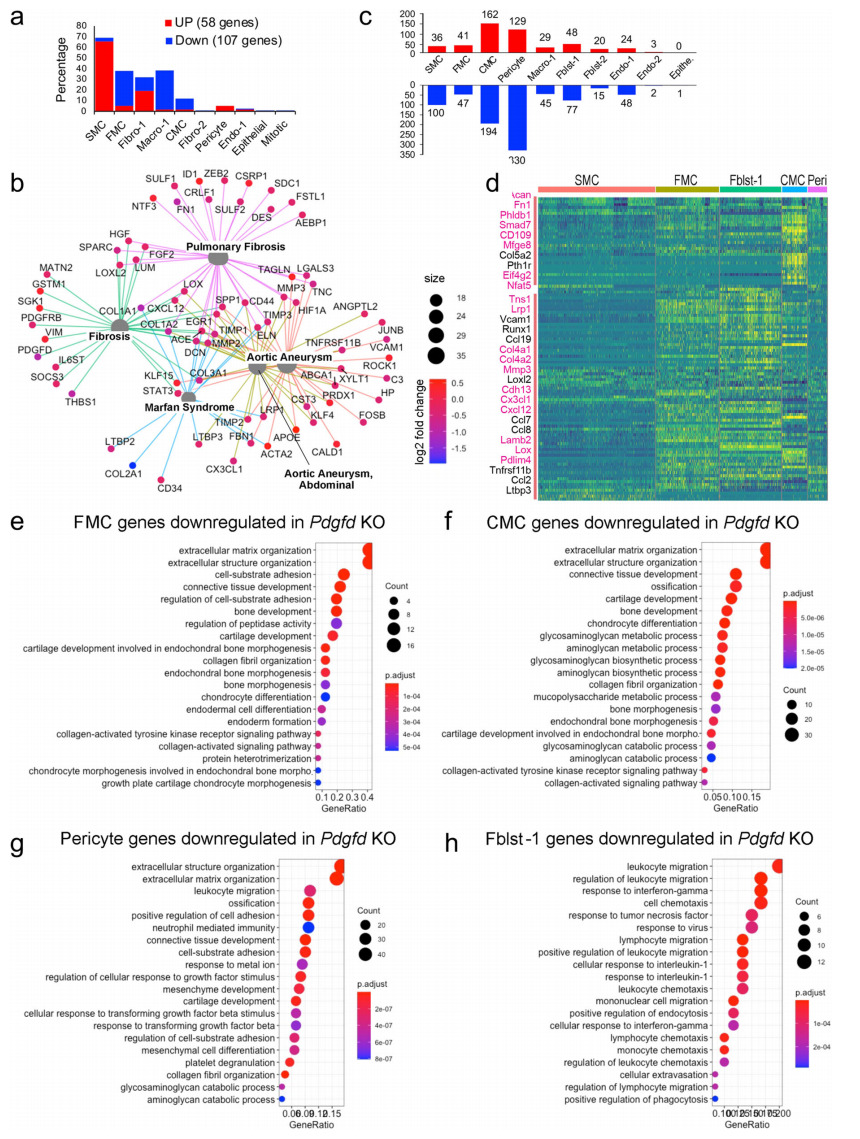
图4 Pdgfd的缺失减轻了平滑肌细胞成软骨转变和炎症通路激活
接下来,他们用组织学方法研究Pdgfd在动脉粥样硬化小鼠模型近端主动脉粥样硬化病变中的作用。首先,他们使用X-gal染色来可视化整合到Pdgfd KO小鼠基因组中的lacZ报告基因的表达。他们观察到与SMC相对应的Xgal染色区域。此外,在近端主动脉,他们观察到斑块状的X-gal染色,以及在主动脉腔内斑块排列的内皮细胞中Pdgfd的表达(图5a)。
他们还利用组织学研究Pdgfd缺失对主动脉根部动脉粥样硬化病变解剖结构的影响,通过比较16周HFD后的KO和Ctl组织,发现KO和Ctl血管的整体面积无差异(图5b),病变面积与全血管相比无明显差异(图5c)。然而,脱细胞面积显著减少(图5d)。重要的是,他们发现血管中的tdT谱系追踪SMC显著减少(图5e,f),这表明Pdgfd负责促进SMC谱系细胞的扩张及其向斑块中的迁移。为了量化与Ctl小鼠相比Pdgfd KO中不同血管腔室中SMC含量的变化,他们进行了Cnn1染色和免疫反应面积测量,发现KO血管内侧层以及整体面积的染色显著增加(图5g-i)。这些结果与scRNAseq数据显示分化的可收缩SMC的血管数量增加的结果一致。在敲除小鼠中,通过CD68染色评估的斑块巨噬细胞含量在整个血管中降低(图5j,k),与单核细胞募集减少一致。此外,与同窝Ctl相比,KO病变中CMC标志物Col2a1和Ibsp的表达显著降低(图5l-n),这种降低与主动脉钙化降低相关(图5o,p)。
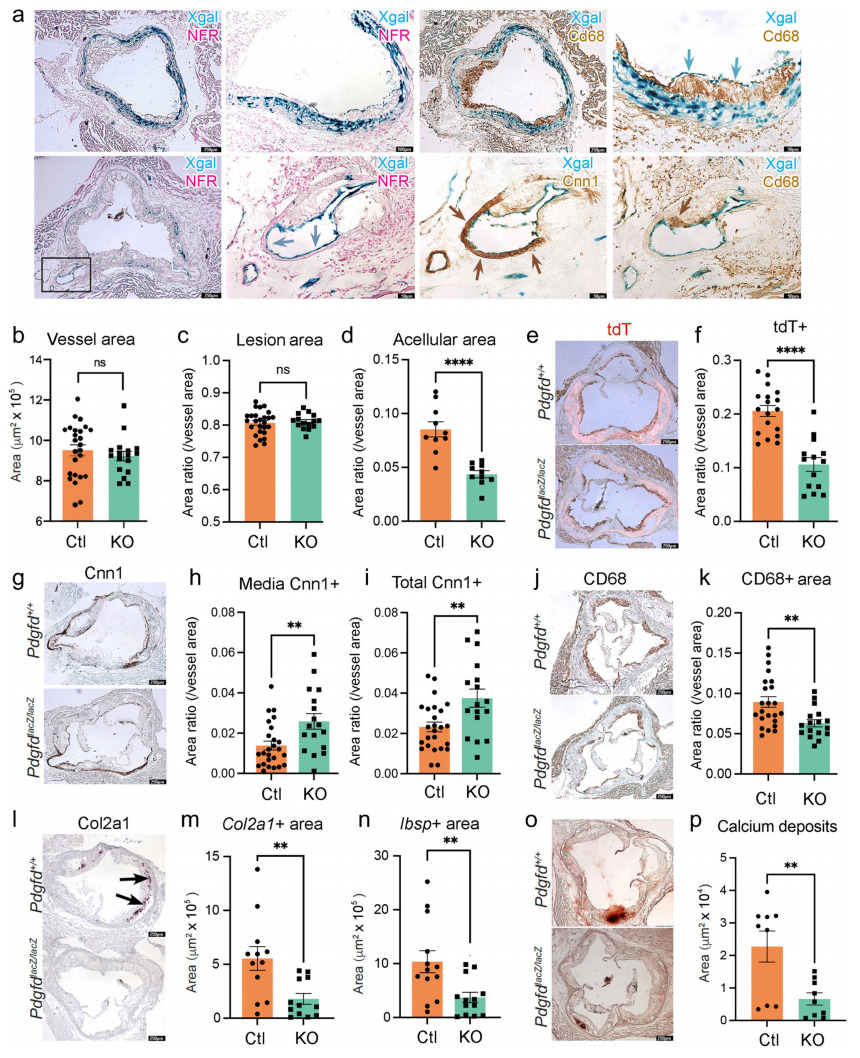
图5 Pdgfd KO可以减轻SMC细胞状态转变和炎症,对斑块负担没有影响
总之,这些结果支持scRNAseq的发现,并提出了Pdgfd表达可能促进疾病风险的两种主要机制。Pdgfd被发现促进SMC的去分化,它们迁移到斑块,并过渡到CMC表型,这与疾病风险相关[6]。事实上,Pdgfd的表达促进血管病变中单核巨噬细胞的数量,从而促进炎症环境。
参考文献
[1] Klarin D, Zhu QM, Emdin CA, et al. Genetic analysis in UK Biobank links insulin resistance and transendothelial migration pathways to coronary artery disease. Nat Genet. 2017;49(9):1392-1397. doi:10.1038/ng.3914
[2] Turner AW, Hu SS, Mosquera JV, et al. Single-nucleus chromatin accessibility profiling highlights regulatory mechanisms of coronary artery disease risk [published correction appears in Nat Genet. 2022 Aug;54(8):1259]. Nat Genet. 2022;54(6):804-816. doi:10.1038/s41588-022-01069-0
[3] Coronary Artery Disease (C4D) Genetics Consortium. A genome-wide association study in Europeans and South Asians identifies five new loci for coronary artery disease. Nat Genet. 2011;43(4):339-344. Published 2011 Mar 6. doi:10.1038/ng.782
[4] Miller CL, Pjanic M, Wang T, et al. Integrative functional genomics identifies regulatory mechanisms at coronary artery disease loci. Nat Commun. 2016;7:12092. Published 2016 Jul 8. doi:10.1038/ncomms12092
[5] Borkham-Kamphorst E, Meurer SK, Van de Leur E, Haas U, Tihaa L, Weiskirchen R. PDGF-D signaling in portal myofibroblasts and hepatic stellate cells proves identical to PDGF-B via both PDGF receptor type α and β. Cell Signal. 2015;27(7):1305-1314. doi:10.1016/j.cellsig.2015.03.012
[6] Cheng P, Wirka RC, Kim JB, et al. Smad3 regulates smooth muscle cell fate and mediates adverse remodeling and calcification of the atherosclerotic plaque. Nat Cardiovasc Res. 2022;1(4):322-333. doi:10.1038/s44161-022-00042-8